2020年8月5日に行なわれた、参天製薬株式会社2021年3月期第1四半期決算説明会の内容を書き起こしでお伝えします。
スピーカー:参天製薬株式会社 代表取締役社長兼CEO 谷内樹生 氏\n参天製薬株式会社 執行役員 中国R&Dスーパーバイザー 森島健司 氏\n参天製薬株式会社 常務執行役員 経営管理担当兼 CFO兼 財務・管理本部長 越路和朗 氏
基本理念とWORLD VISION
谷内樹生氏:それでは谷内からご説明させていただきます。よろしくお願いいたします。まず1ヶ月ほど前ですが、長期ビジョンの説明会にご来場並びにご視聴いただきましてありがとうございました。引き続き取り組んでいきたいと思っています。それでは、スライドの2ページからご説明します。
基本理念である「天機に参与する」は従前からお伝えしているとおりです。前回発表した「WORLD VISION」は私どもの基本使命と考えていますが、こちらの「Happiness with Vision」を今後も引き続き目指して取り組んでいきたいと考えています。
2020年度第1四半期 ハイライト
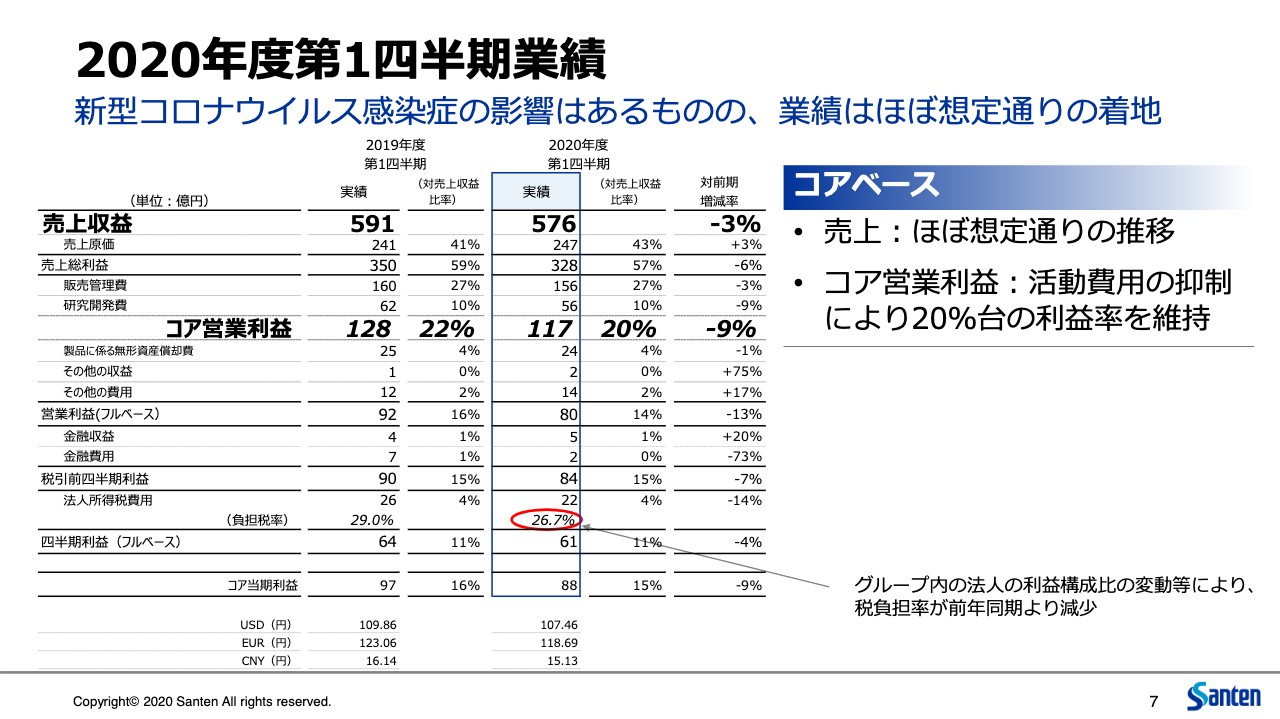
3ページは第1四半期のハイライトです。1つ目は業績ですが、売上収益は576億円、コア営業利益は117億円となりました。業績については個別でさまざまなことがありましたが、全体としては想定どおりと捉えています。
2つ目は米国参入に向けた着実な進捗という点です。中期計画の観点や今年度の活動において、あるいは2020年度を目指した長期ビジョン「Vision2020」の締めくくりという意味でも、米国への参入が私どもにとって大きな挑戦であり大きな機会であると考えていますが、「DE-128」「PRESERFLO MicroShunt」の申請が無事に完了しました。
COVIDの影響等もあり、さまざまな課題が出てくる中、1つひとつ取り組んできた結果だと思っています。引き続き申請を承認いただき、販売を開始して患者さまにお届けできるようになるまで、チーム一丸となって取り組んでいきたいと考えています。
3点目は先般お伝えした長期ビジョンに関連する施策です。以前から取り組んできている活動と同じになりますが、直近でいいますと、すでに発表しているjCyteあるいはPlano、Osmoticaとの提携で、眼瞼下垂という新しい領域のオポチュニティーを獲得できました。
こちらは治療というよりは、治療とウェルネスとのちょうど間にまたがる領域であり、私どもも今後こちらをどのように開発していくのか、あるいは商業化していくのかということで、大変ワクワクしながら取り組んでいます。こちらの案件については、後ほど森島からご説明します。
眼の専門企業としての新型コロナウイルス感染症対応サポート
4ページは新型コロナウイルスへの対応についてですが、COVIDに向けてグローバルでさまざまな取り組みをしています。社内的な取り組み、社外的な取り組みの両方に取り組んでいますが、まずは社外で行なっている事項についてご説明します。
1つは、我々ならではのできることはないかということで、スリットランプシールドを配布しています。こちらは国によっていろいろなタイミング、あるいは規制に対応しながらというかたちになりますが、全世界に配布していく考えで製作しています。
目の検査はあごを乗せて目をのぞき込むスリットランプという機械が必須になりますが、こちらはかなり近い距離で患者さまとお医者さまが接することになります。しかし機械をのぞき込む必要があるため、いわゆるフェイスシールドが使えません。
そのような中でもさまざまな取り組みがありますが、「スリットランプシールドで何かよいものがないか」という患者さまや先生方の声を聞き、現在こちらを製作して配っています。
また、テレワークが進んだり、あるいは外で遊べないという中でふだんと違う目の問題が出てきていたり、患者さまが情報を信用できずに困っていることもあるため、一般の方に向けた目に関する情報の提供を行なっています。
加えて、「Webinar」を使って眼科医にCOVIDに関することや一般的な情報提供を行なうなど、眼科のリーディングカンパニーとしてさまざまな活動を行なっています。
Santenが目指すNew Normalに向けた働き方
5ページは社内的な事項ですが、6月頃からスライドにある取り組みを全世界で始めており、現在も時間と場所にとらわれない働き方を実践しています。
また、こちらに合わせたさまざまな人事的な規制の対応や、テクノロジーのさらなる活用を全世界レベルで見直しており、基本的には会社に出社せずに世界中の社員と仕事ができる、あるいは会社に行かなくてもさまざまな事務手続きが完了するという環境を構築して進めています。
そのような中でオフィスのあり方について、スライドの写真は東京オフィスですが、いわゆる通勤して働く場所ではなく「人と人が集う場所としてのオフィス」という新しいあり方を実践していくかたちに順次変えていくことも行ないました。
「New Normal」を機会として取り入れ、生産性を高めていけるようなかたちで取り組み、業績も含めて進めていきたいと考えていますので、引き続きご支援のほどよろしくお願いします。谷内からは以上です。
2020年度第1四半期業績
越路和朗氏:越路です。7ページをご覧ください。先ほどのハイライトと若干重複しますが、第1四半期の損益計算書の状況です。売上、コア営業利益は減収減益となりましたが、今年度の第1四半期は新型コロナウイルスの影響をもっとも多く織り込んでいましたので、そのような点では想定どおりの着地と認識しています。
2020年度第1四半期 売上収益(前年同期比)
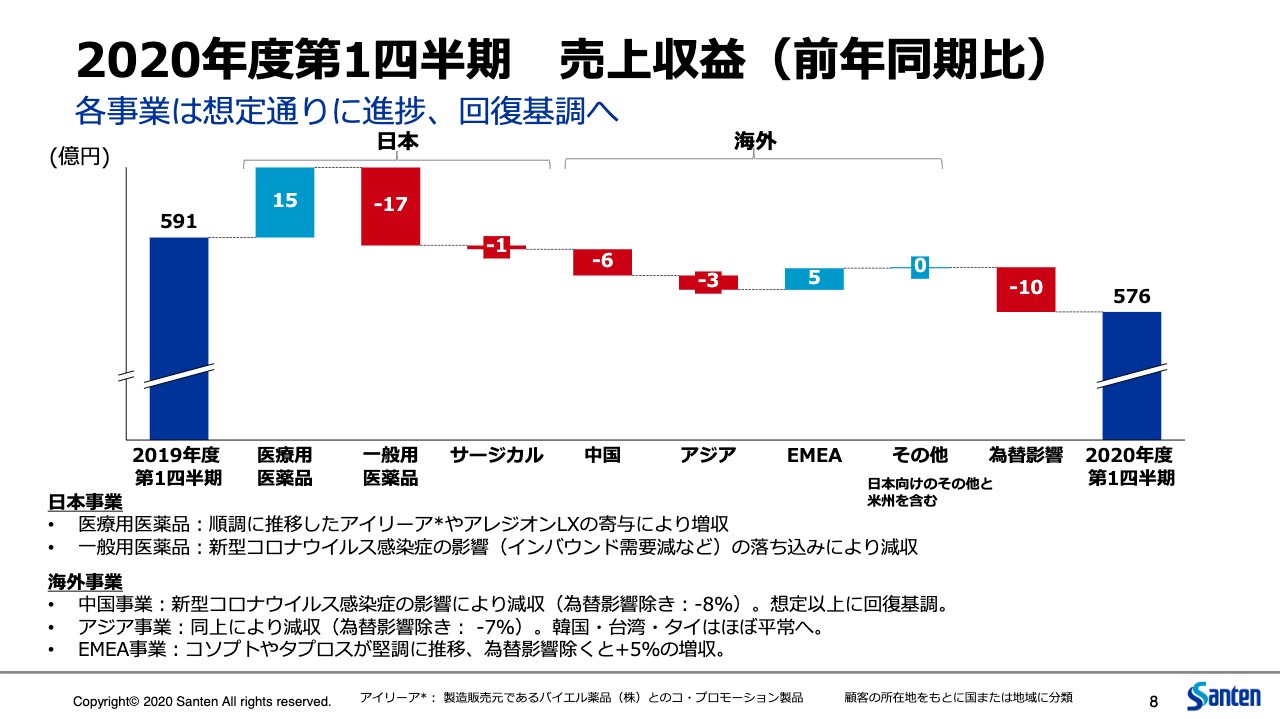
8ページは売上のブリッジで、前年度との比較です。国内はほぼ横ばい、海外は前年比で6.5パーセントの減収という結果ですが、そのうち外国為替レートの影響が海外トータルで4.5パーセントほどありましたので、そのような点では実質的には前年比で2パーセントほどマイナスとなりました。ただし、状況としては想定よりも軽微となりました。
日本事業と海外事業の個別の事項については、スライドの下部に注記しているとおりです。それぞれの為替影響を除いたマイナス幅を記載しています。
2020年度通期業績予想:5月8日開示から変更なし
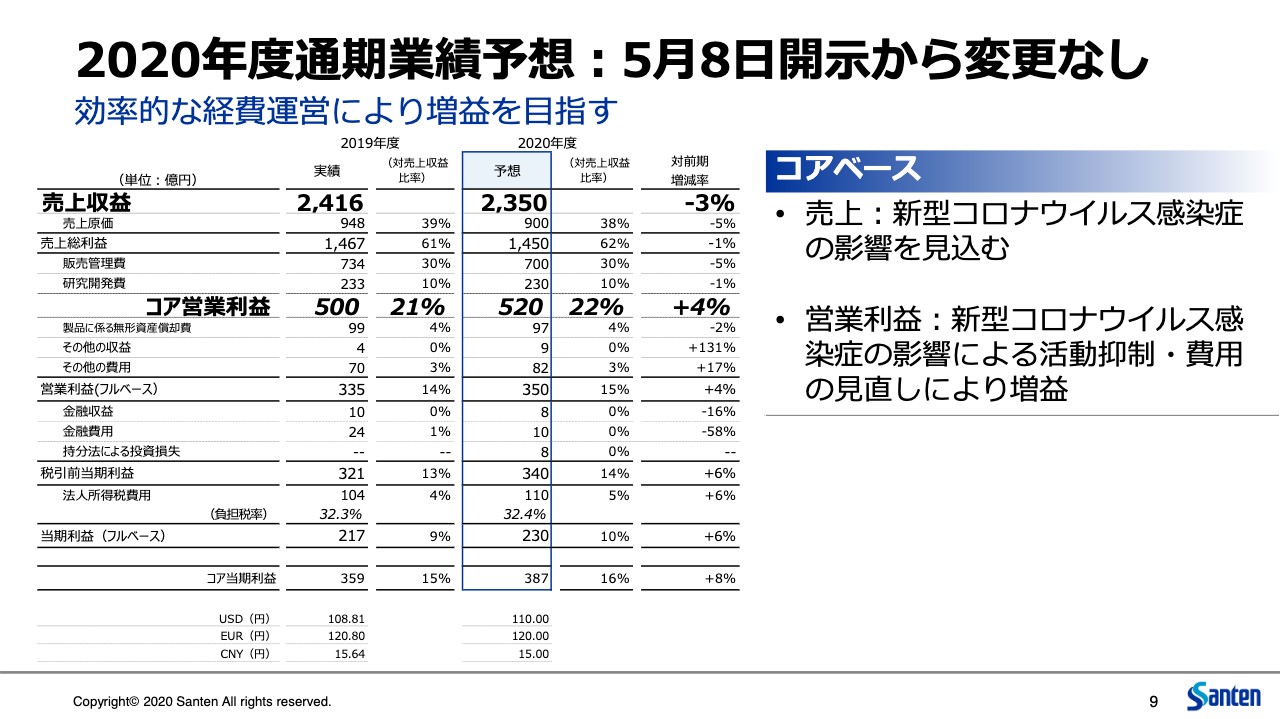
9ページは通期の業績予想ですが、こちらは変更はありません。この第1四半期の結果を踏まえて、先ほどからお伝えしているように想定どおりの数字であると認識しています。
4分の1ずつでは25パーセントの進捗率となりますが、今年度の第1四半期は新型コロナウイルスの影響をもっとも重く考えていましたので、売上では約20パーセントほどの進捗、コア営業利益では20パーセントを若干下回るような進捗を想定していました。そのような点では、今回の着地は売上、利益とも当初の計画を上回っていると認識しています。
今後のP/Lの考え方としては、依然として新型コロナウイルスの影響は不確実性を伴うと認識しています。したがって、第1四半期の売上2,350億円は想定どおりの着地でしたが、そこから今後回復基調に乗っていけるのかについては不確実性が伴います。
我々としては売上や売上総利益がどのような状況でも、販売管理費を柔軟にコントロールし、かつ研究開発費が必要なものは使うことによって、コア営業利益を期初業績予想のとおり確保する考え方でいます。よって、今期は業績予想について現段階では変更する予定はありません。
Osmotica社提携:後天性眼瞼下垂
森島健司氏:森島からは研究開発の現状を報告します。11ページは、7月に米国のOsmoticaと後天性眼瞼下垂治療薬についての提携を発表したことについてご説明します。
眼瞼下垂は目を開いたときに上瞼が正常な位置より下がった状態になる病気です。先天性と後天性がありますが、主に加齢によって瞼を持ち上げる筋肉が衰えることで起こると考えられています。50歳以上の人の瞼の病気としてはもっともポピュラーなものの1つです。垂れ下がった瞼により上方が見えにくい、また眠そうに見えるなどの症状が現れます。
見た目に影響することから美容系のイメージを持たれるかもしれませんが、視野に影響したり、肩こり、頭痛、疲れる等の症状を引き起こす病気であり、日本では保険適用で治療されます。ある調査では50歳以上の方の約1割が眼瞼下垂との報告もあります。
現在の治療法は手術で垂れた瞼を引き上げるというものですが、Osmoticaは7月に眼瞼下垂に対する点眼での治療薬の承認を米国で得ています。
Osmotica社提携:RVL-1201
12ページです。米国で承認された薬はオキシメタゾリン塩酸塩0.1%点眼液「RVL-1201」です。点眼することで上瞼を持ち上げる筋肉の1つであるミュラー細胞に作用し、症状が改善されます。参天は日本、中国、アジア、欧州での開発ライセンスを取得しており、今後それぞれの地域での開発を開始します。
これまで手術しか治療法がなかった疾患に対して、点眼治療という新しい治療法を提案することでオプションが増え、治療のハードルを下げることができると期待しています。
研究開発の現状①
13ページからは、研究開発の各パイプラインの主に変化があった事項のみをご紹介します。なお、開発コードの附番ルールの変更を行なったため、今回は新旧コードを併記しています。
1つ目の「DE-111」は中国でP3試験を実施しています。新型コロナウイルスの影響もあり、P3試験の完了は2022年度になる見込みです。
「DE-117」は、日本、アジア、米国での4つのP3試験を含む計11の臨床試験をもとに、今年度下期に米国で申請します。米国で行なった2つのP3試験のうち1つの試験で主要評価項目を達成できなかったものの、すでにFDAとの申請前相談も済ませており、申請できるデータがそろったものと考えています。
「DE-128」は6月に申請を完了しており、7月に申請が受理されています。予定どおり今年度中の承認、上市を見込んでいます。
研究開発の現状②
14ページです。開発品についてはスライドに記載のとおりであり、前回からの変更もないため、今回は説明を割愛します。なお、依然として新型コロナウイルスの影響が臨床試験などに影響する可能性がありますので、いずれのプロジェクトも計画が遅れるリスクがあることをご承知おきください。