2021年2月17日に行われた、アンジェス株式会社2020年12月期決算説明会の内容を書き起こしでお伝えします。
スピーカー:アンジェス株式会社 代表取締役社長 山田英 氏
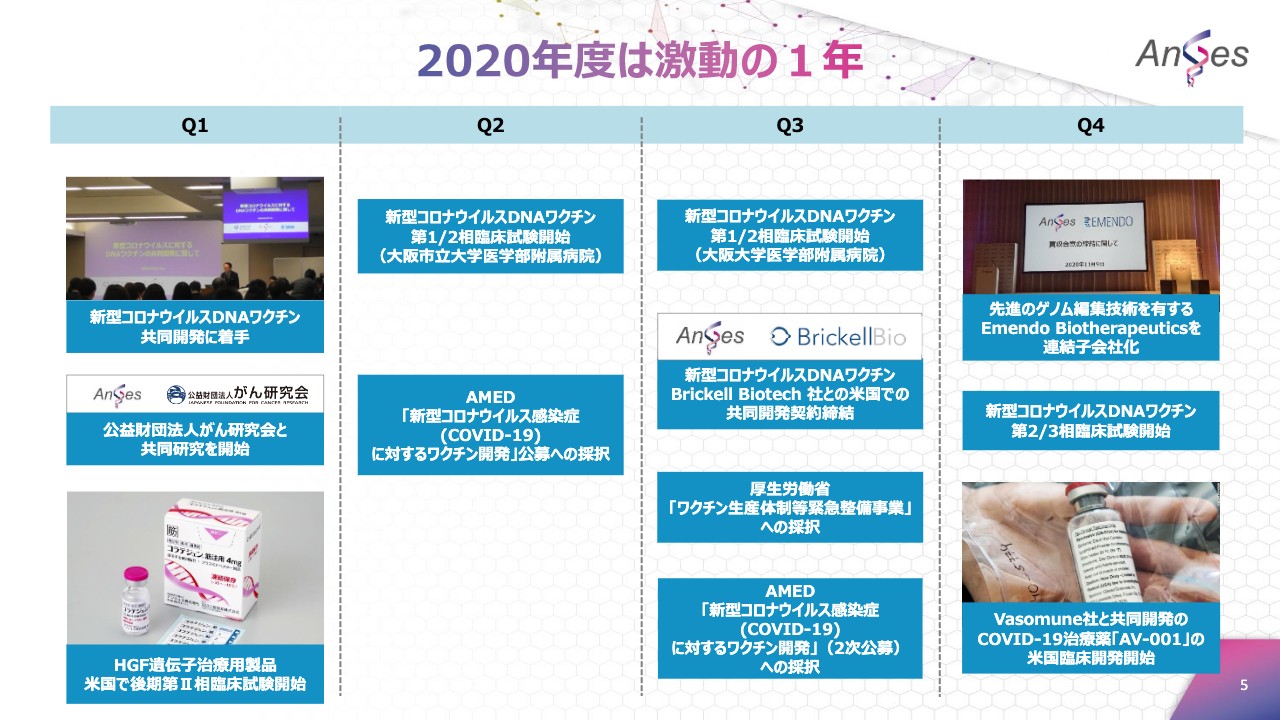
2020年度は激動の1年
山田英氏:みなさま、このたびはご参加いただきましてありがとうございます。アンジェスの山田でございます。これより、アンジェス株式会社2020年12月期の決算をご報告させていただきます。
それでは、まず2020年度総括についてご説明させていただきます。当社にとって、2020年度はどんな年だったかを一言で申しますと、激動の1年でした。昨年は多くのニュースを発信させていただきましたが、こちらのスライドは四半期ごとのトピックをまとめたものでございます。
世界初のプラスミド製剤による遺伝子治療用製品で培ったノウハウを活かし、新型コロナウイルスDNAワクチン開発を始めました。
激動の1年の中でも、2020年度の2大トピックとしましては、新型コロナウイルスDNAワクチン/治療薬の開発開始と、Emendo Biotherapeuticsの買収でございます。それぞれにつきましてご説明させていただきます。
1つ目のトピック、新型コロナウイルスDNAワクチン/治療薬の開発開始についてです。まずは、ワクチンについて。世界初のプラスミド製剤による遺伝子治療用製品で培ったノウハウを活かし、3月に新型コロナウイルスDNAワクチンの開発を開始しました。
”新型コロナウイルス”ワクチン開発について
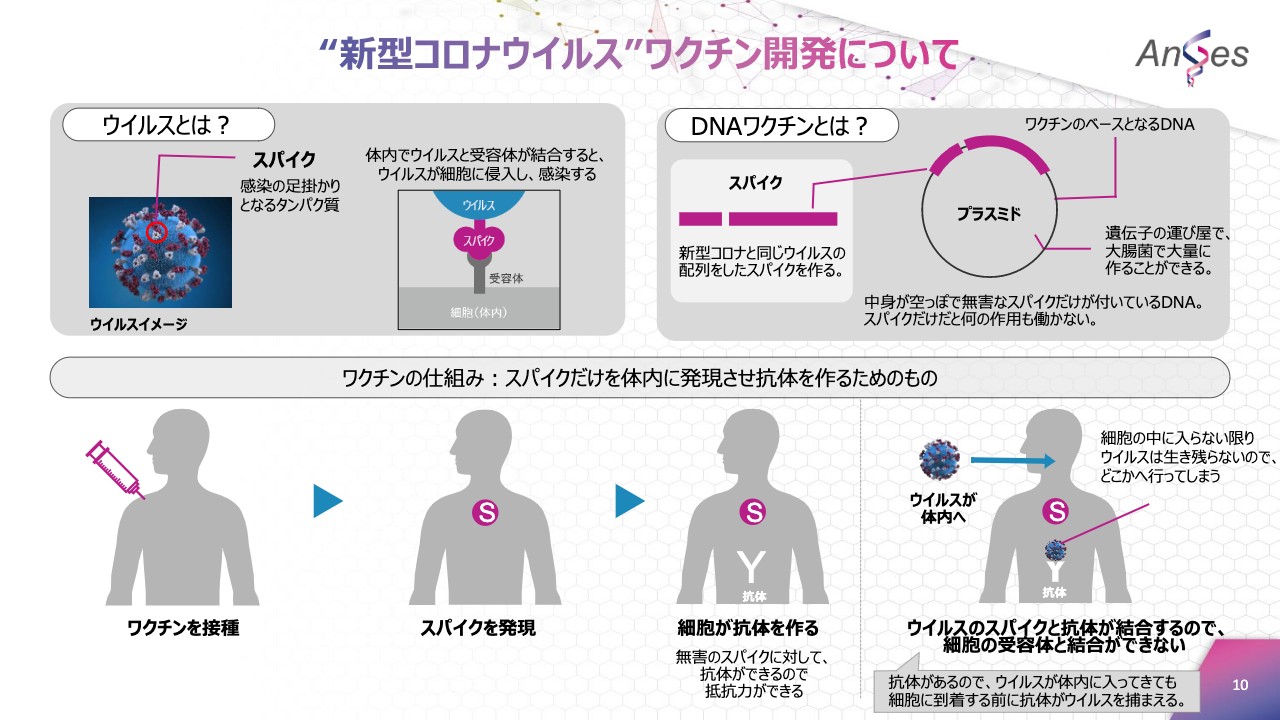
こちらは、新型コロナウイルスワクチンの仕組みを図にしています。ウイルスとは、感染の足掛かりとなるタンパク質であるスパイクが、体内で受容体と結合すると、ウイルスが細胞に侵入し、ウイルス感染します。
ワクチンの仕組みでございますが、DNAワクチンは新型コロナウイルスと同じウイルスの配列をしたスパイクを作ります。このスパイクは無害なスパイクです。
ワクチンのベースとなるスパイクのDNAを、体内に摂取します。ワクチンは無害なスパイクだけを体内に発現させ、細胞が抗体を作り、体に抵抗力ができます。
ウイルスが体内に入ってきても、細胞に到着する前に抗体がウイルスを捕まえるため、細胞の受容体とウイルスが結合せず、ウイルス感染を防ぐことができるという仕組みでございます。
新型コロナウイルスDNAワクチンの開発状況
3月に大阪大学と、当社が有するプラスミドDNA製品の開発実績を活用し、共同で新型コロナウイルス対策のための予防用DNAワクチンの開発に着手しました。
第Ⅰ相、第Ⅱ相臨床試験の全接種が完了し、現在は500人規模の第Ⅱ相、第Ⅲ相臨床試験を実施中です。また今後の予定としましては、1万人から数万人規模の第Ⅲ相臨床試験を実施予定でございます。
COVID‐19治療薬とは
続いて、COVID-19治療薬「AV-001」について説明いたします。弊社が開発を進めているCOVID-19治療薬とは、カナダのバイオ医薬品企業であるVasomuneと共同開発を進めています「AV-001」という、「Tie2チロシンキナーゼ受容体アゴニスト」のことです。
2018年より全世界を対象に、急性呼吸不全など血管の不全を原因とする疾患を対象とした医薬品として、共同開発を実施しています。
”新型コロナウイルス”治療薬開発について
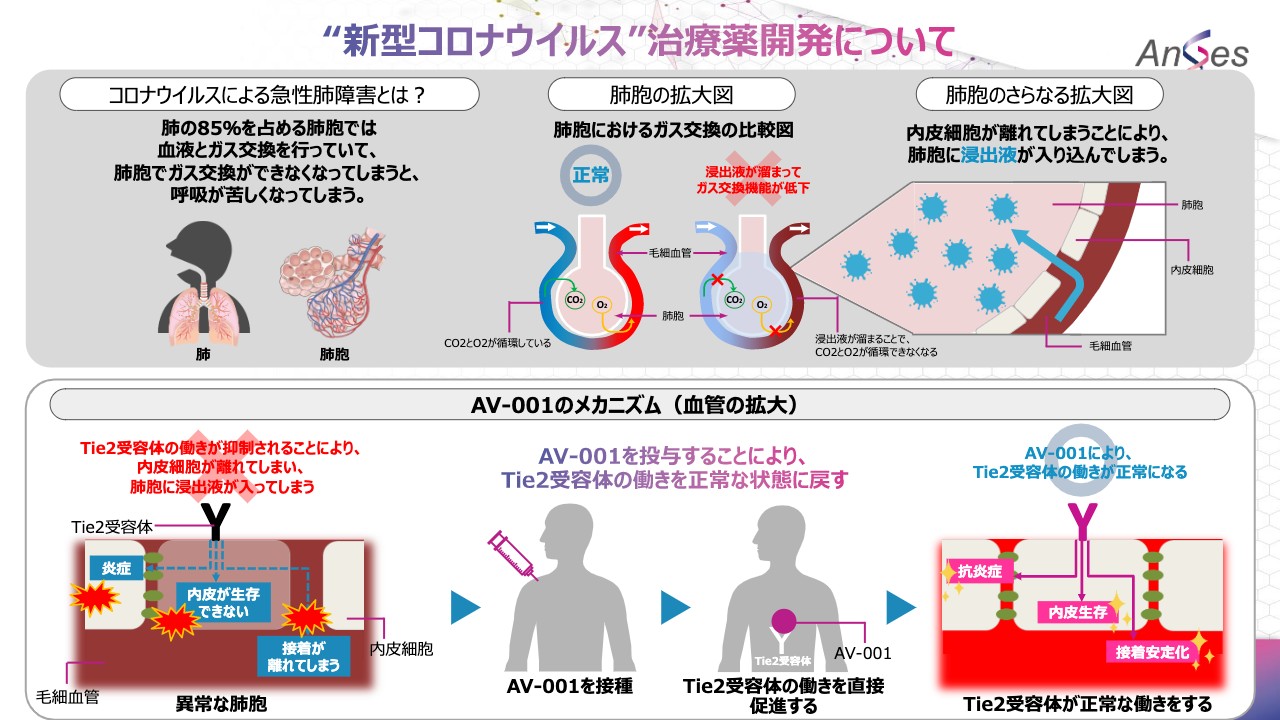
こちらは、COVID-19治療薬の仕組みを図にしています。コロナウイルスによる急性肺障害とは、肺の85パーセントを占める肺胞では血液とガス交換を行っていて、肺胞でガス交換ができなくなってしまうと、炎症を起こしたり水が溜まったりして、呼吸が苦しくなってしまいます。
「AV-001」のメカニズムでございますが、左下の図をご覧ください。Tie2と呼ばれる受容体の働きが抑制されることにより、内皮細胞が離れてしまい、肺胞に水が入り炎症を起こしたり、内皮が生存できない、また、肺胞と内皮細胞の接着が離れてしまいます。
そこで「AV-001」を投与することによりTie2の働きを直接促進し、Tie2の働きが正常になり、抗炎症、接着安定化されるというメカニズムでございます。
新型コロナウイルス感染症 治療薬の開発状況
この「AV-001」が、中等度から重度のCOVID-19肺炎患者の治療に効果があるとして、2020年より米国で第Ⅰ相臨床試験を行っています。
今後に関してですが、第Ⅰ相臨床試験に続く臨床試験でも良好な結果が得られれば、中等度から重度のCOVID-19治療薬として、米国食品医薬品局(FDA)に緊急使用許可を申請することを検討しています。
先進のゲノム編集技術を有する、米国のEmendo Biotherapeuticsを買収
続いて、Emendo Biotherapeuticsの子会社化について説明いたします。先進のゲノム編集技術を有する米国のEmendo Biotherapeuticsの買収手続きが昨年12月に完了し、子会社化いたしました。
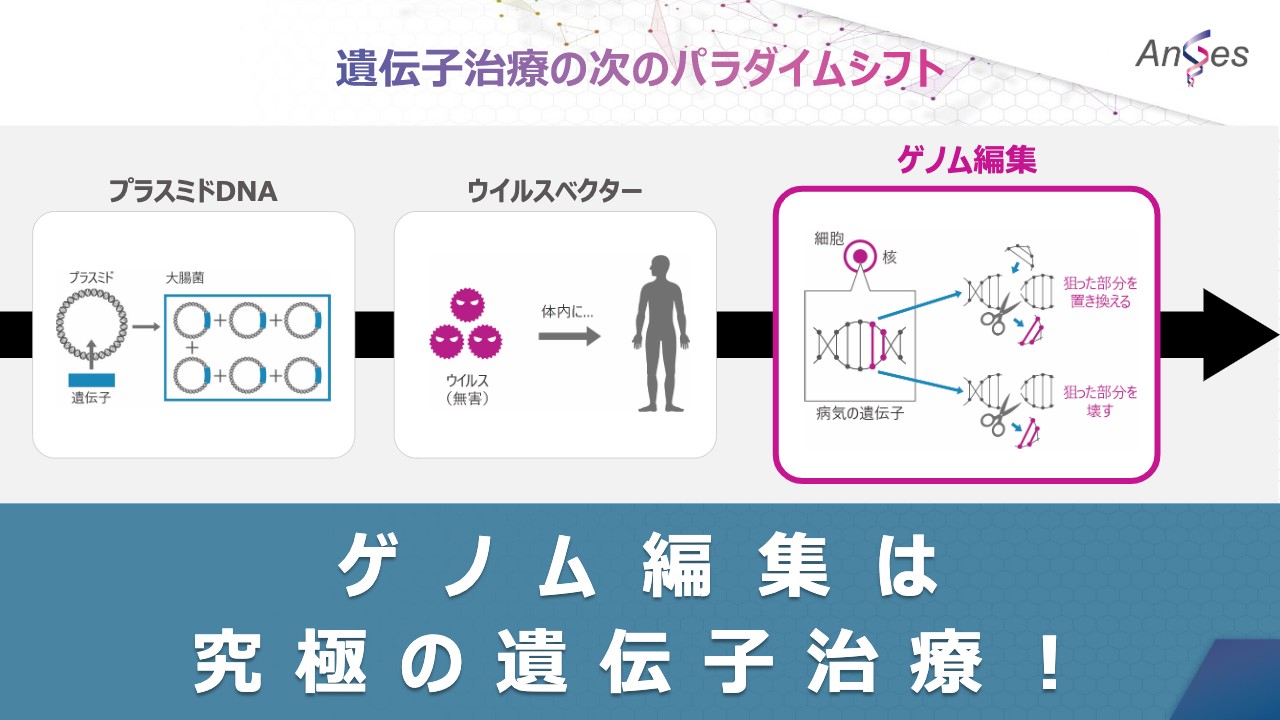
遺伝子治療の次のパラダイムシフト
遺伝子治療の分野では、プラスミドやウイルスベクターの手法を用いた遺伝子治療用製品はすでに上市されていますが、遺伝子治療の次のパラダイムシフトはゲノム編集であると考えています。
近年、ゲノム編集技術により特定の遺伝子の機能を失わせたり、疾患の原因となっている遺伝子の異常を修正する方法が開発されています。
ゲノム編集とは①
ところで、ゲノム編集とは何かについて説明させていただきます。ゲノム編集とは、特定の塩基配列(ターゲット配列)のみを切断するDNA切断酵素(ヌクレアーゼ)を利用して、思いどおりに遺伝子を改変する技術でございます。
ゲノム編集とは②
ゲノム編集は1990年代中頃から研究が行われ始めましたが、諸々の課題がございました。2012年には、これまでよりも短時間で簡単に標的とするDNA配列を切断できる技術である「CRISPR-Cas9(クリスパーキャスナイン)」が登場しました。
この「CRISPR-Cas9」の開発者が昨年ノーベル化学賞を受賞しましたが、この技術は世界中で注目を集めており、ゲノム編集のヒトへの適用が待ち望まれています。
ゲノム編集の次世代キープレーヤー Emendo Biotherapeutics
そんなゲノム編集の次世代キープレーヤーとなるのが、Emendo Biotherapeuticsでございます。Emendo Biotherapeuticsは合成生物学を駆使し、ゲノム編集の領域で対応できる適応症を拡大することを目的に、2015年に設立されました。
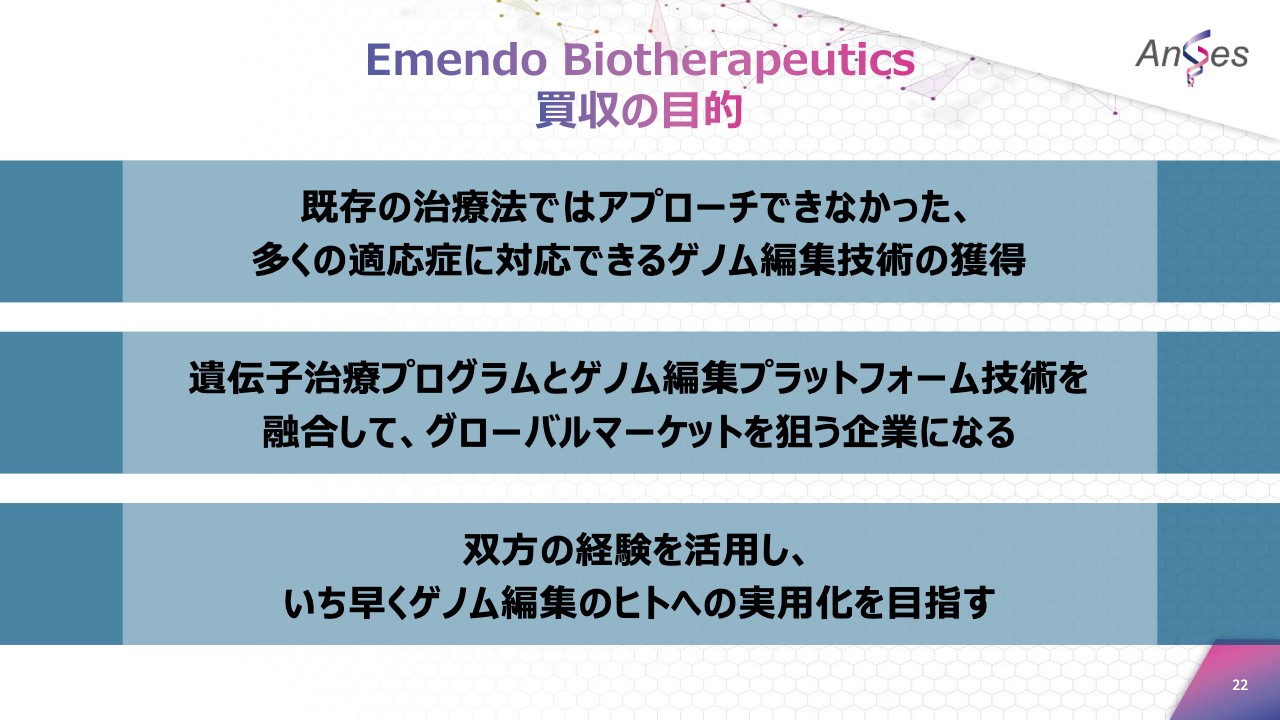
Emendo Biotherapeutics 買収の目的
当社がEmendo Biotherapeuticsを子会社化しましたのは、「既存の治療法ではアプローチできなかった、多くの適応症に対応できるゲノム編集技術の獲得」「遺伝子治療のプログラムとゲノム編集プラットフォーム技術を融合して、グローバルマーケットを狙う企業になる」「双方の経験を活用し、いち早くゲノム編集のヒトへの実用化を目指す」の、以上の3点を目的にしてございます。
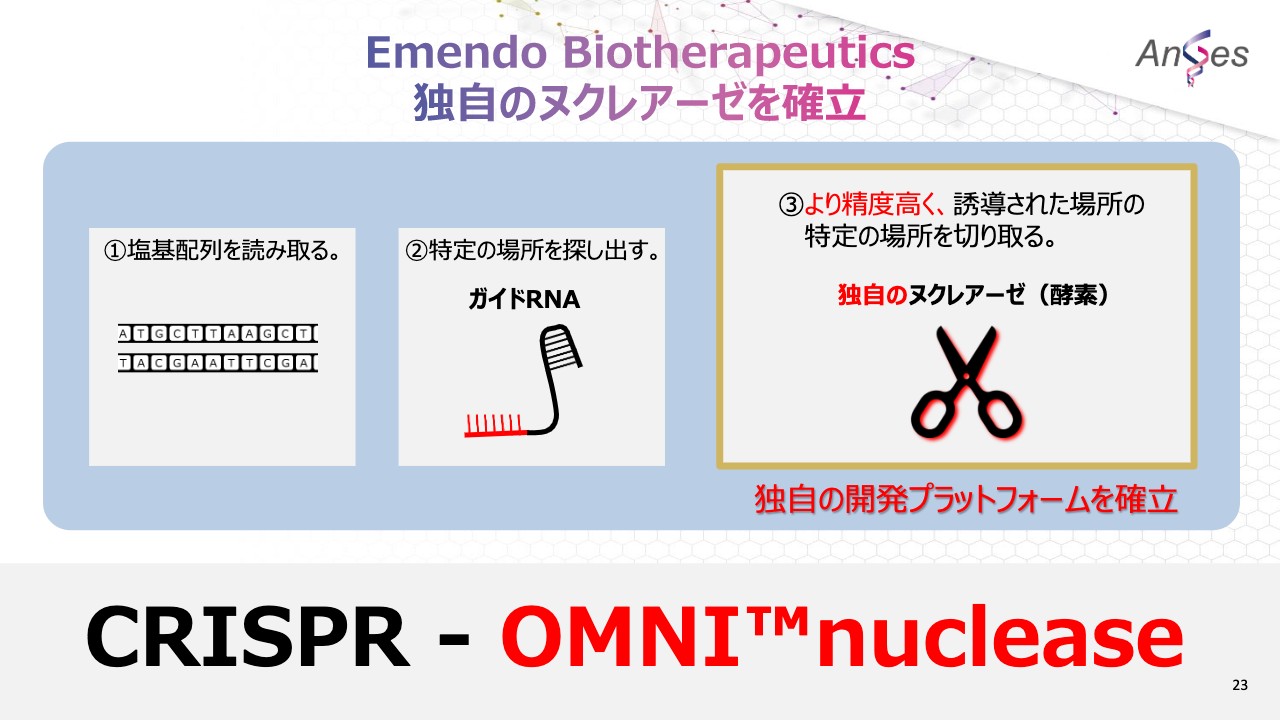
Emendo Biotherapeutics 独自のヌクレアーゼを確立
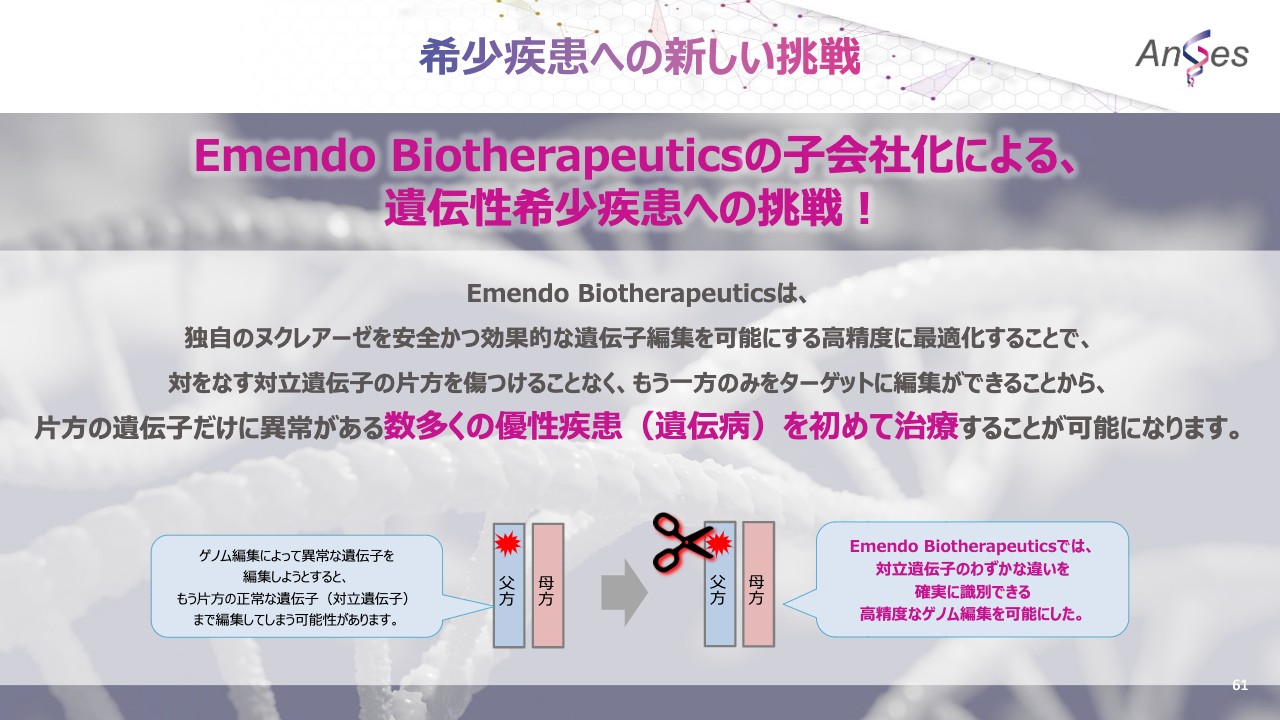
Emendo Biotherapeuticsの技術のすばらしい点は、より精度高く、誘導された場所の特定の場所を切り取る独自のヌクレアーゼを確立した点です。そんなEmendo Biotherapeuticsのゲノム編集技術の名称は、「CRISPR-OMNI™nuclease」と言います。
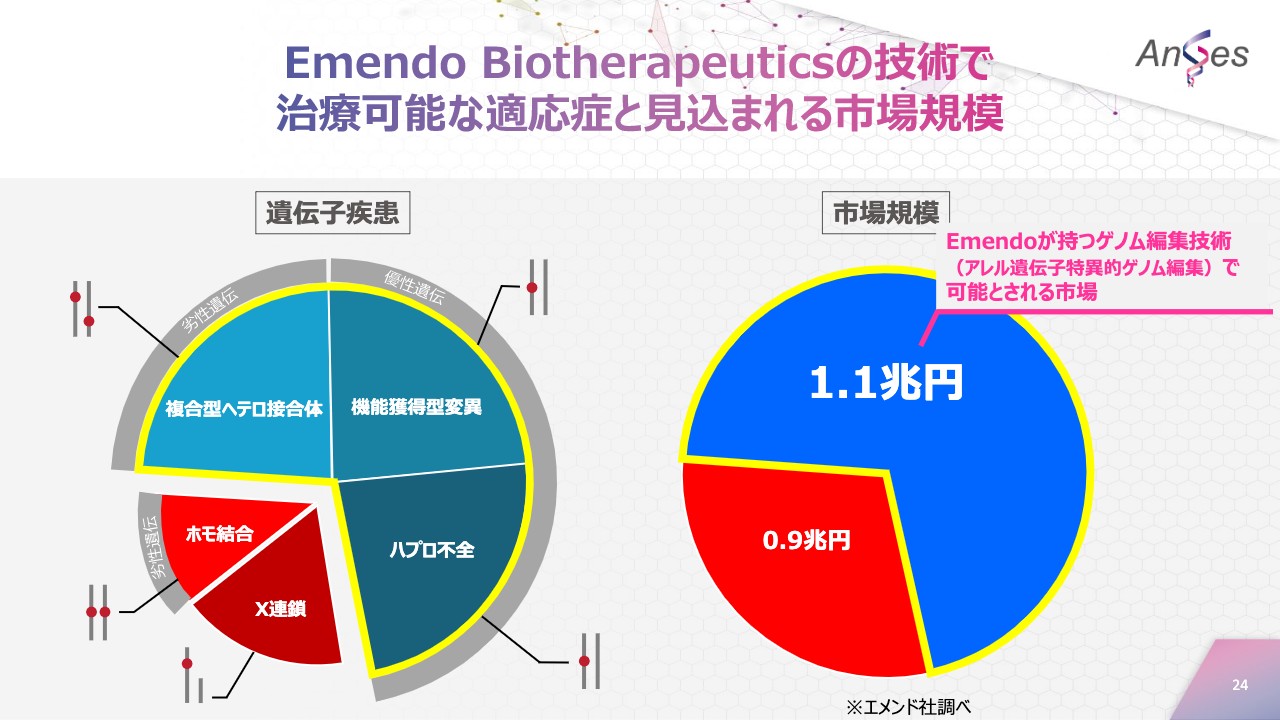
Emendo Biotherapeuticsの技術で治療可能な適応症と見込まれる市場規模
こちらは、Emendo Biotherapeuticsの技術で治療可能な適応症と、見込まれる市場規模を表しています。Emendo Biotherapeuticsの技術により、左の円グラフのうち黄色い枠線で囲われている遺伝子疾患を初めて治療することが可能になり、その市場規模は1兆1,000億円とされており、今までよりも大きな市場を対象にすることができます。
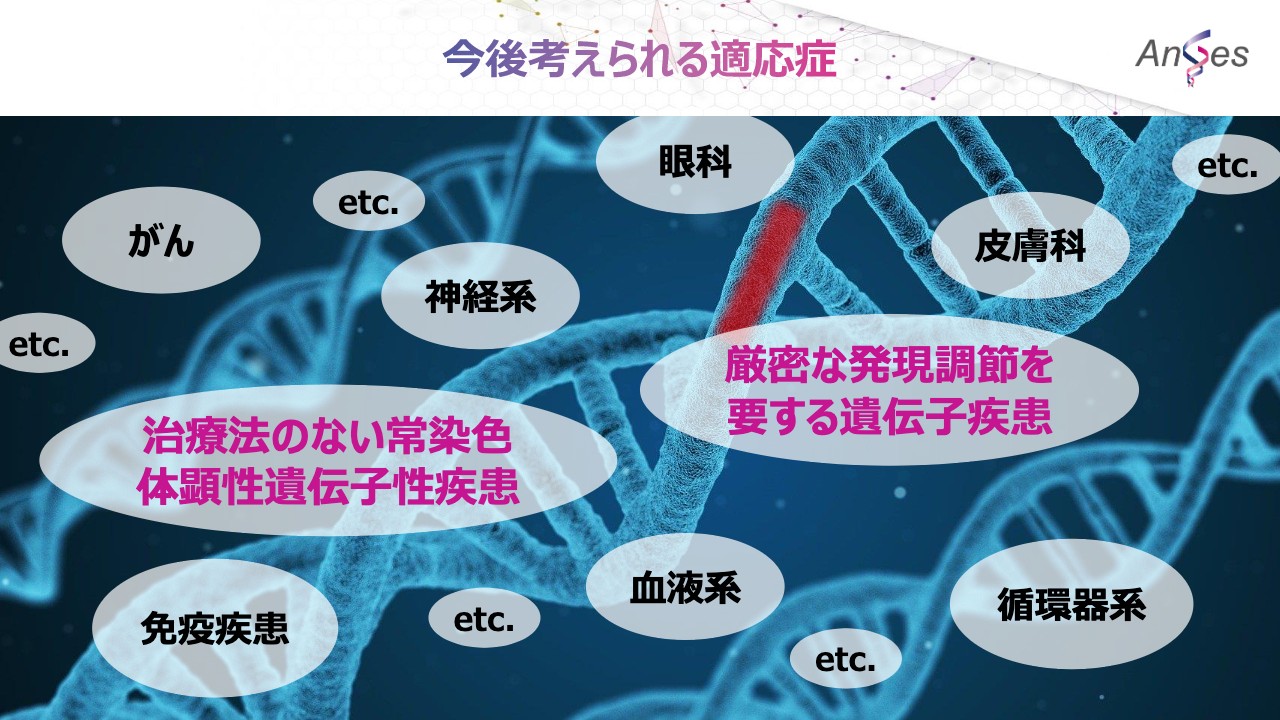
今後考えられる適応症
今後考えられる適応症として、がんや神経系、眼科、皮膚科、免疫疾患など、数多くの治療法のない常染色体顕性遺伝子性疾患や、厳密な発現調節を要する遺伝子疾患が考えられます。
Emendo Biotherapeuticsを買収したことで、
Emendo Biotherapeuticsを子会社化したことで、ゲノム編集の技術のIP(特許)を保有することになり、自社創薬の領域が広がりました。アンジェスの遺伝子治療薬の上市実績から、ゲノム編集技術のヒトへの適用により実用化に近づくと考えています。
AnGes
日本初の遺伝子創薬企業である当社は、米国を含むグローバルでの事業展開を加えることで世界的な遺伝子医薬企業になり、遺伝子治療のプログラムと次世代ゲノム編集プラットフォーム技術を有する世界初の企業となります。
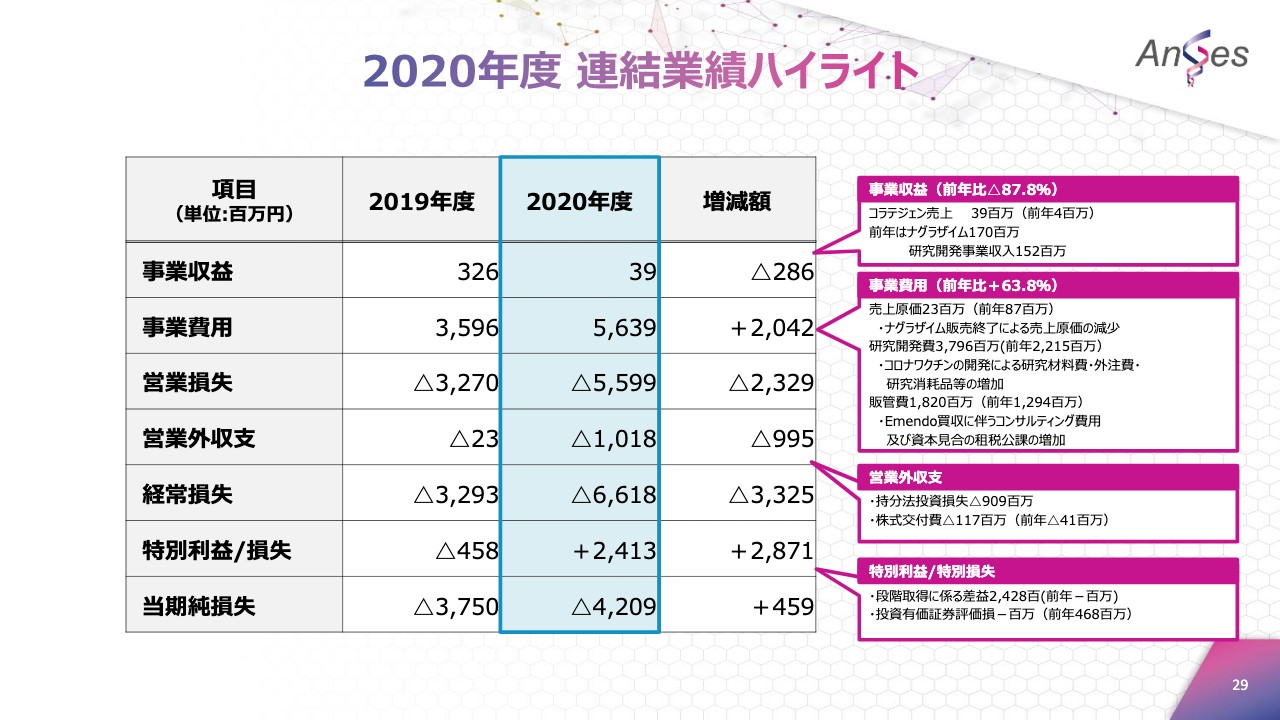
2020年度 連結業績ハイライト
続いて、2020年12月期決算サマリーに関してご説明させていただきます。こちらは業績のハイライトとなります。事業収益は3,900万円でした。これは「コラテジェン」の売上による収益でございます。この数字は、当社から田辺三菱製薬への出荷数量に基づくものです。
事業費用は56億3,900万円となります。営業外収支は10億1,800万円のマイナスで、のれん相当償却、および持分に応じたEmendo損失の取り込みが含まれています。特別利益は24億1,300万円で、段階取得に係る差益が24億2,800万円でございました。当期の純損失は42億900万円のマイナスでございます。
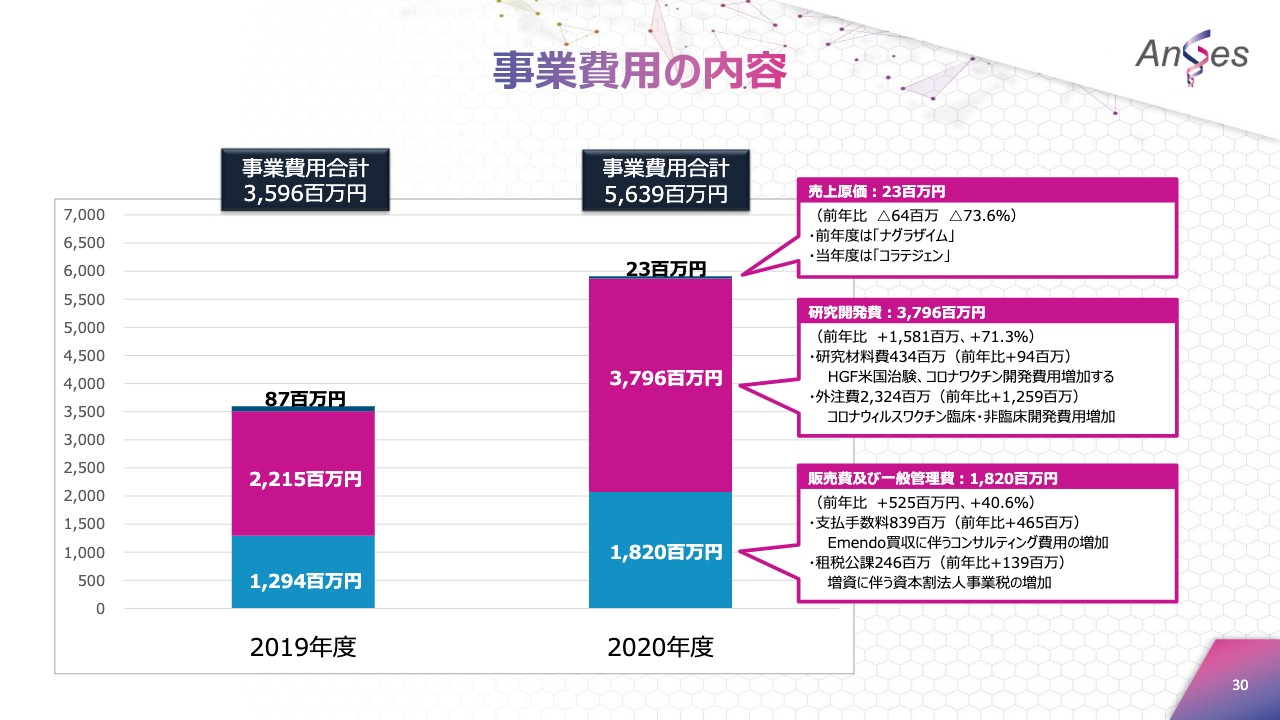
事業費用の内容
事業費用の内容でございます。合計額は約56億円で、内訳としましては、売上原価は2,300万円。研究開発費が37億9,600万円。研究材料費は、HGF遺伝子治療用製品の米国での治験や、新型コロナウイルスのワクチン開発費用により増加。
また、外注費もコロナウイルスワクチンの臨床・非臨床試験の開発費用により増加いたしました。販管費は18億2,000万円で、Emendo Biotherapeutics買収に伴うコンサルティング費用や増資に伴う資本割法人事業税により、前年比増加しています。
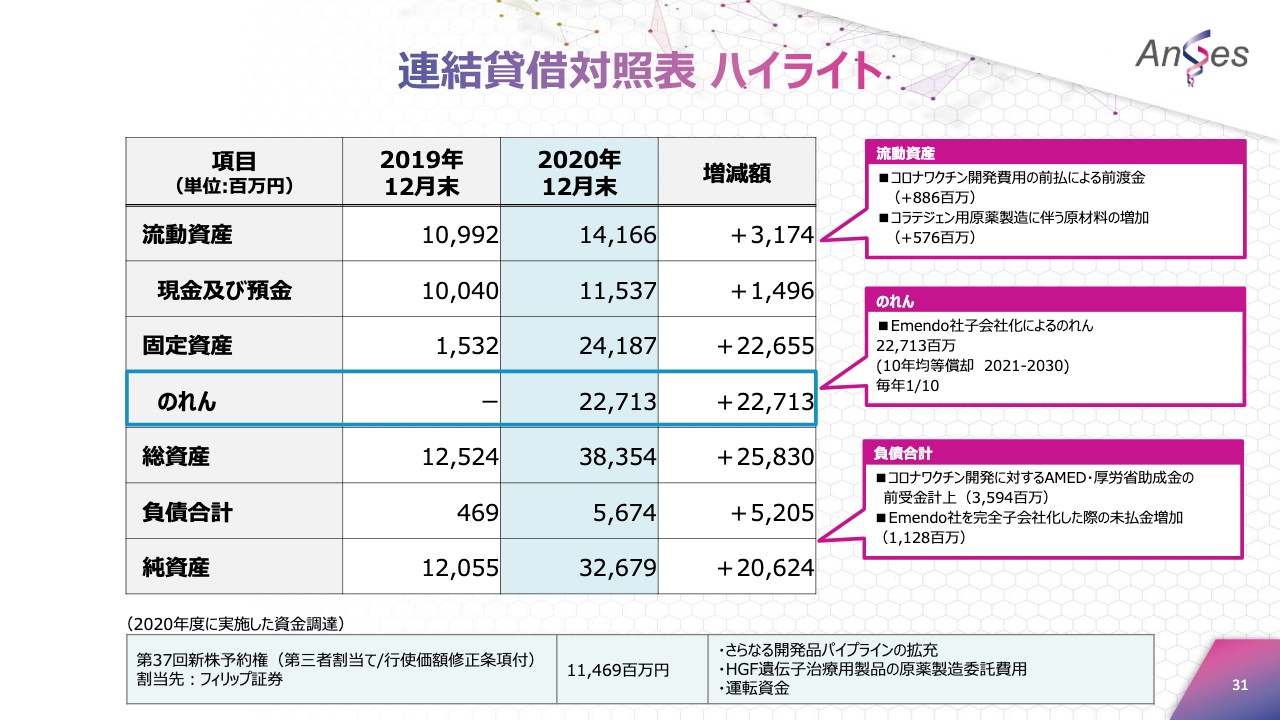
連結貸借対照表 ハイライト
貸借対照表につきましては、総資産は前年度末と比べて258億3,000万円増えて、383億5,400万円となりました。現金および預金は、前年度末と比べて14億9,600万円増えて、115億3,700万円。
固定資産は、Emendo Biotherapeuticsを子会社化したことによるのれんを計上したことで、昨年度末と比べて226億5,500万円増えて、241億8,700万円となりました。なお、こののれんは本年から2030年までの10年間で均等償却されます。また、コロナワクチン開発に対するAMED・厚生労働省の助成金は、前受金で計上しています。
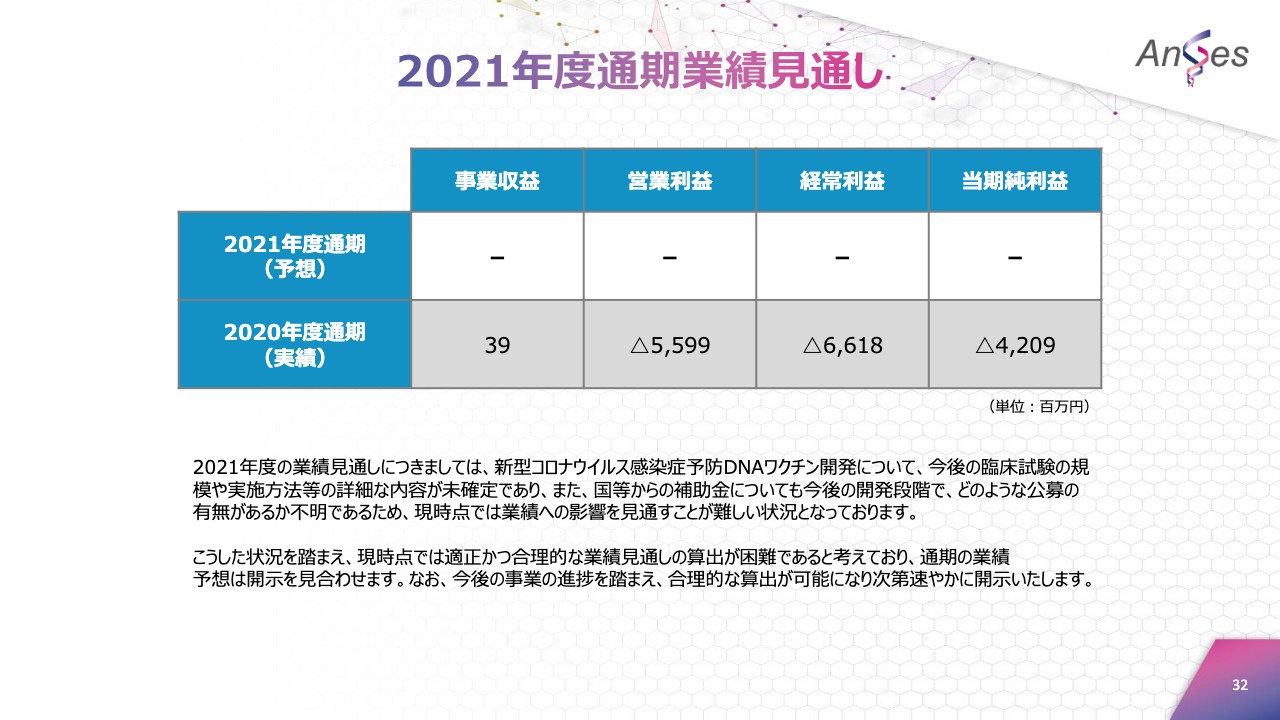
2021年度通期業績見通し
2021年度の業績見通しにつきましては、新型コロナウイルス感染症予防DNAワクチン開発について、今後の臨床試験の規模や実施方法等の詳細な内容が未確定であります。また、補助金についても今後の開発段階でどのような公募の有無があるか不明であるため、現時点では業績への影響を見通すことが難しい状況となっています。
こうした状況を踏まえ、現時点では適正かつ合理的な業績見通しの算出が困難であると考えており、通期の業績予想は開示を見合わせます。なお、今後の事業の進捗を踏まえ、合理的な算出が可能になり次第速やかに開示いたします。
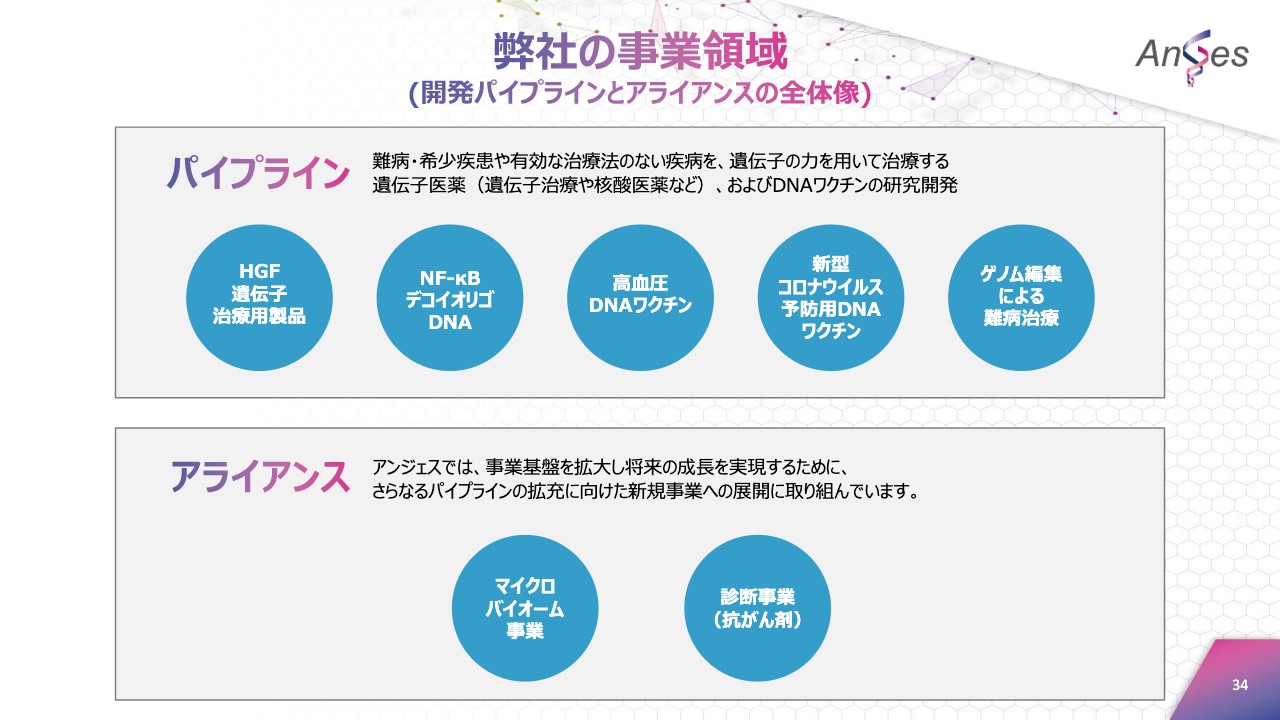
弊社の事業領域
ここからは、事業別にトピックスをご説明いたします。弊社の事業領域(開発パイプラインとアライアンスの全体像)は、ご覧いただいている資料のとおりです。
現在アンジェスでは、難病・希少疾患や有効な治療法のない疾病を対象とした、遺伝子医薬およびDNAワクチンを研究開発しています。また、事業基盤を拡大し、将来の成長を実現するために、開発品パイプラインの拡充に向けた活動に取り組んでいます。
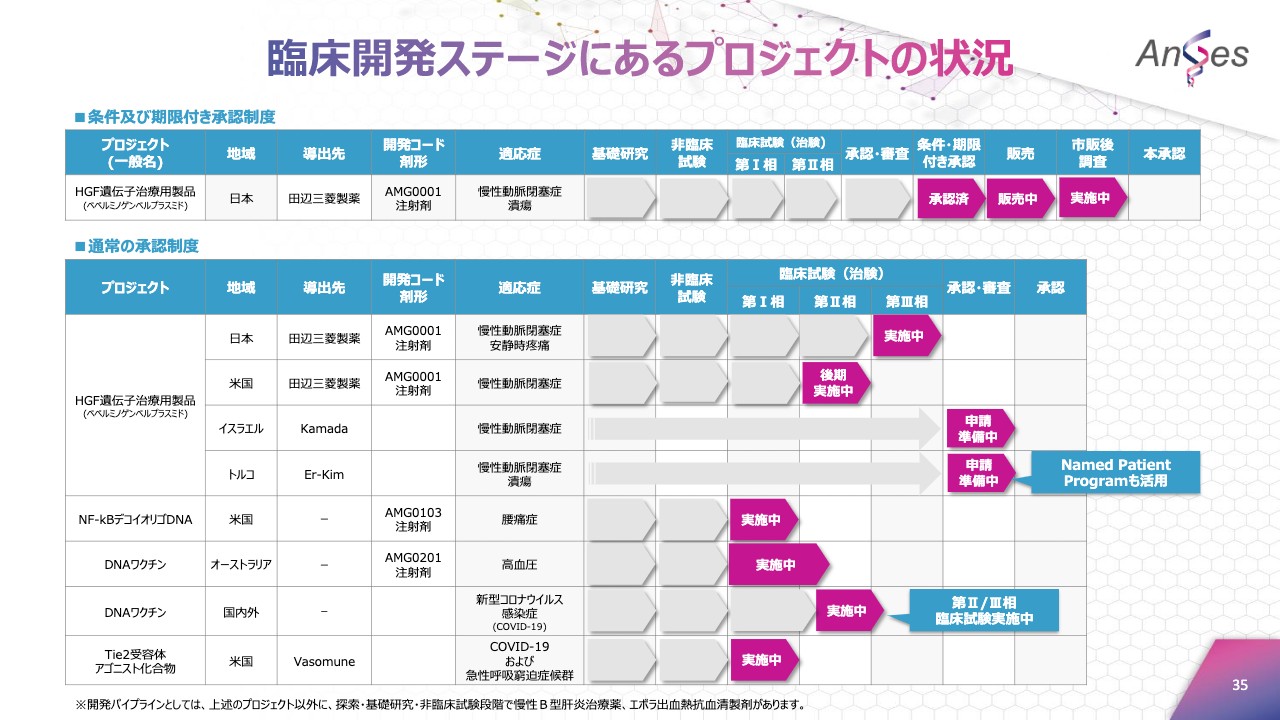
臨床開発ステージにあるプロジェクトの状況
開発パイプラインの進捗状況は、ご覧いただいているスライドのとおりです。主な進捗としましては、昨年3月より着手しています新型コロナウイルス感染症のDNAワクチン開発を主に進めていました。その他のプロジェクトにつきましても、粛々と継続して開発を進めています。
パイプライン
続いて、各プロジェクトの詳細を説明します。HGF遺伝子治療用製品の開発状況でございます。
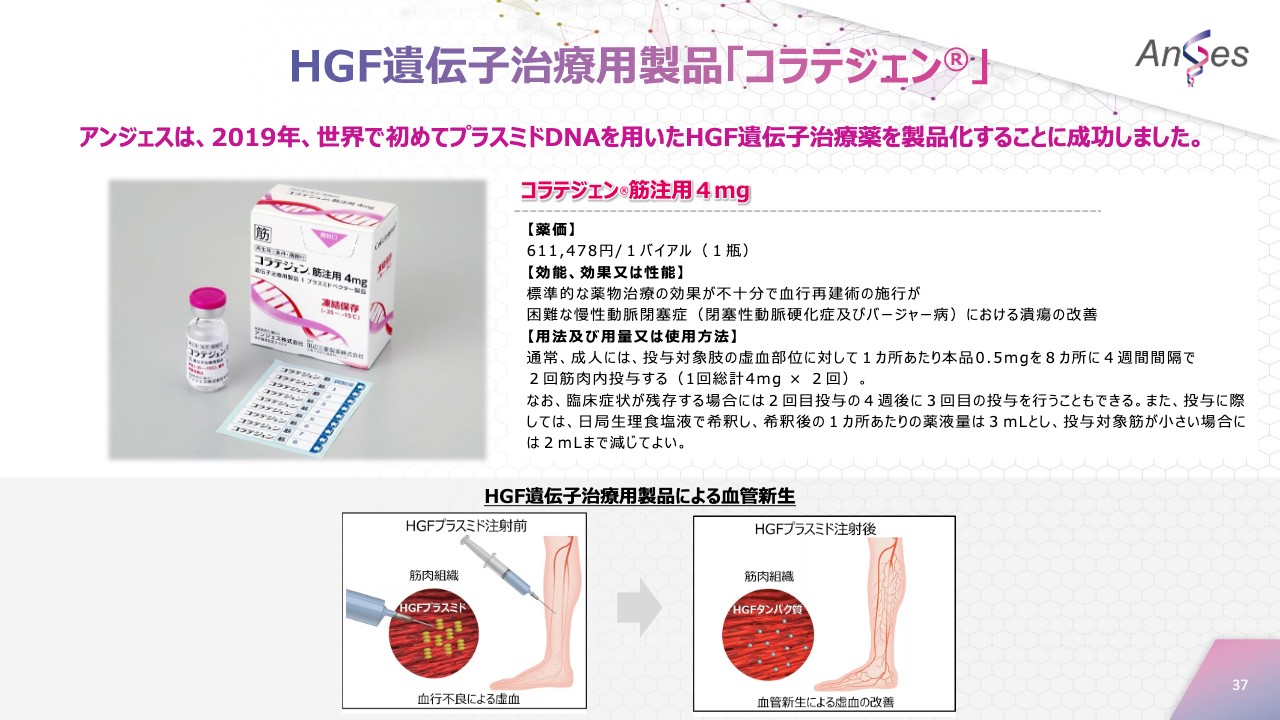
HGF遺伝子治療用製品「コラテジェン」
アンジェスは2019年、世界で初めてプラスミドDNAを用いたHGF遺伝子治療薬を製品化することに成功しました。
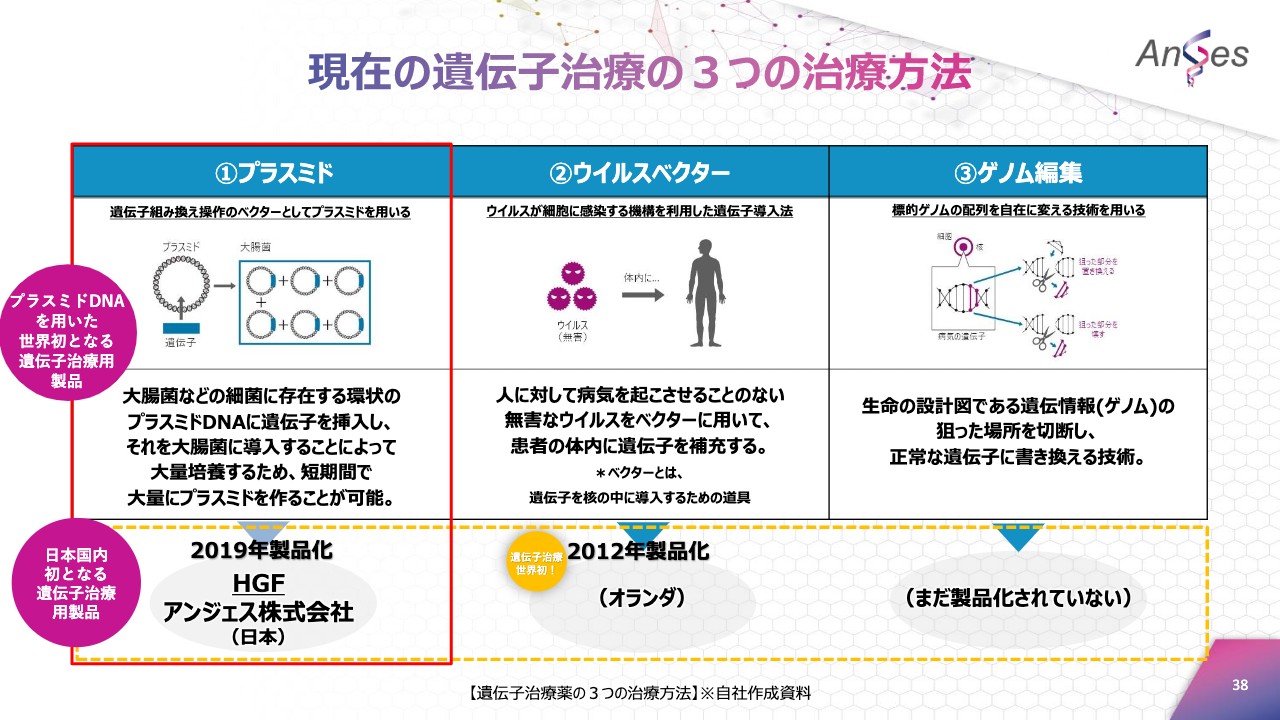
現在の遺伝子治療の3つの治療方法
こちらは、遺伝子治療用製品の3つの治療法を図にしています。先ほど申し上げましたが、当社のHGF遺伝子治療用製品は、世界で初めてのプラスミド製剤による遺伝子治療用製品として上市いたしました。
当社のHGF遺伝子治療用製品は、1つの国内初と4つの世界初となる製品です。
また、世界初のプラスミド製品であるだけでなく、「国内初の遺伝子治療用製品」「世界初のHGF実用化製品」「世界初の末梢血管を新生する治療用製品」「世界初の循環器医療領域での治療用製品」と、1つの国内初と4つの世界初となる製品でございます。
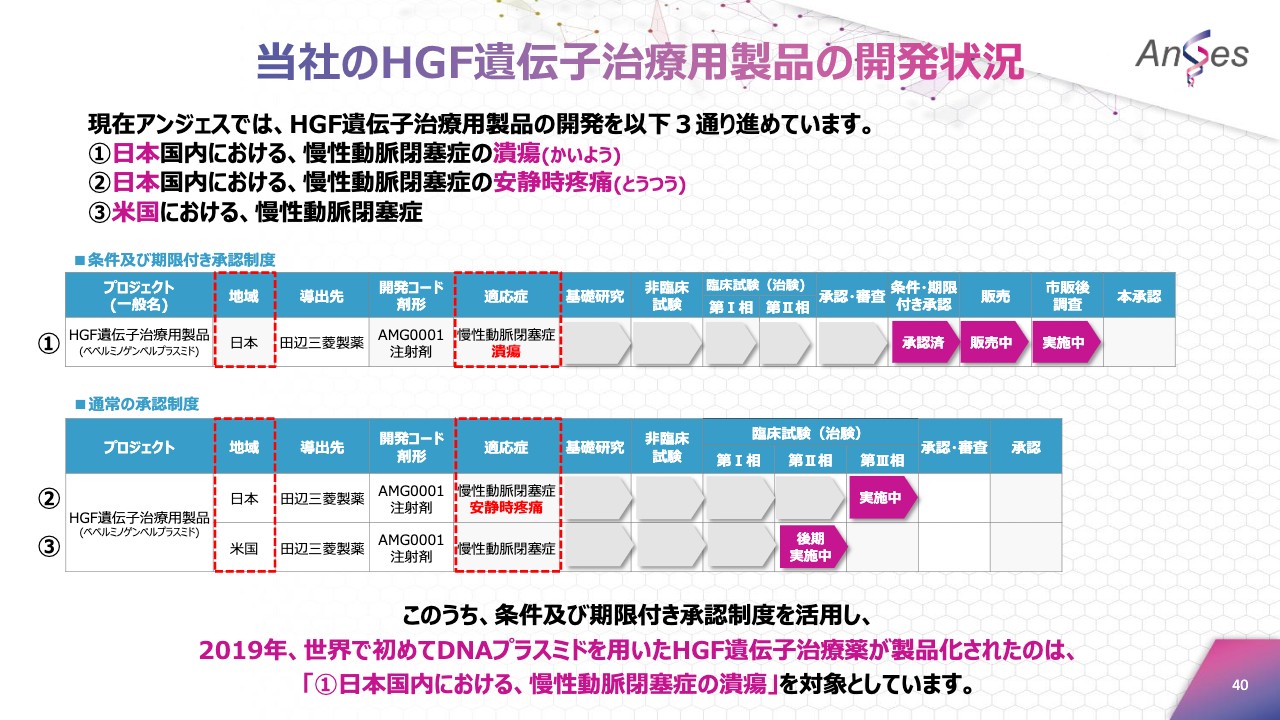
当社のHGF遺伝子治療用製品の開発状況
こちらは、当社が進めているHGF遺伝子治療用製品の開発状況でございます。「日本国内における慢性動脈閉塞症の潰瘍」「日本国内における慢性動脈閉塞症の安静時疼痛」「米国における慢性動脈閉塞症」の開発を進めています。
このうち、条件および期限付き承認制度を活用し製品化されたのは、「日本の国内における慢性動脈閉塞症の潰瘍」を対象としています。
HGF遺伝子治療用製品①(慢性動脈閉塞症の潰瘍、国内)
国内における慢性動脈閉塞症の潰瘍に関してですが、こちらは条件および期限付き承認制度により2019年9月に上市して以降、現在は市販後調査を実施中でございます。
2020年12月時点で約80例まで調査は進んでいます。なお、慢性動脈閉塞症の潰瘍とは、血管が完全に詰まり、血流が遮断され、栄養や酸素の不足により虚血性の潰瘍や壊疽が起こる状態のことでございます。
HGF遺伝子治療用製品③(慢性動脈閉塞症の潰瘍、海外)
また、米国では2019年6月に改定されたグローバルの新しいガイドラインに沿って、下肢切断リスクの低い患者を対象に、後期第Ⅱ相臨床試験を進めています。
NF-κBデコイオリゴDNA 開発状況
続いて、NF-κBデコイオリゴDNAの開発状況でございます。
NF-κBデコイオリゴDNA(椎間板性腰痛症治療薬)
こちらは昨年2月に発表いたしましたが、米国にて後期第Ⅰ相臨床試験の25例の患者投与が完了しています。現在は有効性の評価を進めています。
高血圧DNAワクチン 開発状況
続いて、高血圧DNAワクチンの開発状況でございます。
高血圧DNAワクチン
高血圧DNAワクチンに関してでございますが、昨年3月にオーストラリアにて、第Ⅰ相および前期第Ⅱ相臨床試験の患者投与が完了しており、先日、経過観察期間を経て「重篤な有害事象はなく、安全性に問題がない」という試験結果を発表させていただきました。
マイクロバイオーム事業
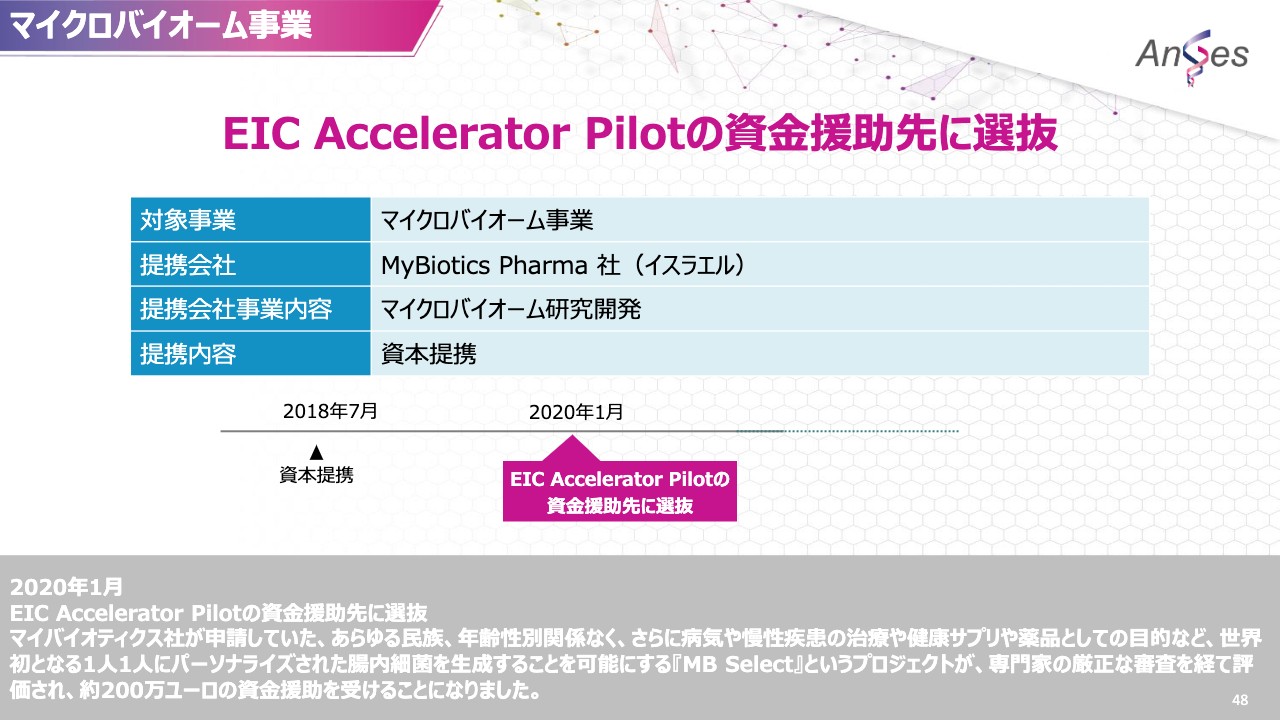
続いて、マイクロバイオーム事業でございます。こちらは、イスラエルのMyBiotics Pharmaとの取り組みでございます。
昨年の1月でございますが、MyBiotics Pharmaが申請していました、あらゆる民族、年齢、性別関係なく、さらに病気や慢性疾患の治療や健康サプリや薬品としての目的など、世界で初めてとなる一人ひとりにパーソナライズされた腸内細菌を生成することを可能にする「MB Select」というプロジェクトが専門家の厳正な審査を経て評価され、EU当局に関連する団体から約200万ユーロの資金援助を受けることになりました。
我々は、このような将来性のある技術を、どのようなかたちで実用化していくかを検討しているところでございます。
診断事業(抗がん剤)
続いて、抗がん剤に関する診断事業でございます。こちらは、イスラエルのBarcode Diagnosticsとの取り組みになります。現在は早期の実用化に向け、まずは公益財団法人がん研究会にて、Barcode Diagnosticsの診断技術の評価を進めているところでございます。
アンジェス 2021年度の指針
続きまして、2021年度の指針についてご説明申し上げます。2021年度は一言で申しますと、「今取り組んでいるものを実らせるべく、駆け抜けていく年」にしてまいりたいと思います。
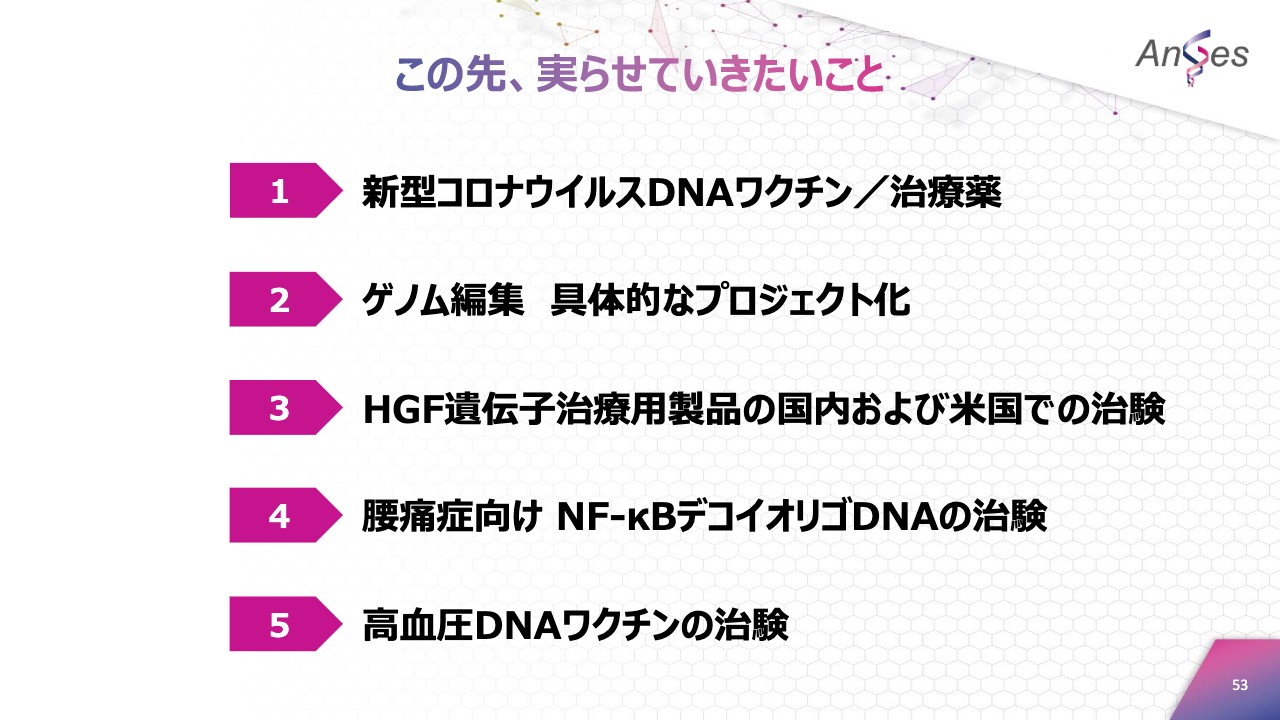
この先、実らせていきたいこと
そのために「この先、実らせていきたいこと」として、「新型コロナウイルスDNAワクチンおよび治療薬」「ゲノム編集の具体的なプロジェクト化」「HGF遺伝子治療用製品の国内および米国での治験」「腰痛症向けNF-κBデコイオリゴDNAの治験」「高血圧DNAワクチンの治験」の5つを掲げています。
持続可能な開発目標(SDGs)
最後に、今後の当社の取り組みについてご説明申し上げます。みなさんご存知のことと思いますが、昨今、Sustainable Development Goals、いわゆるSDGsを経営の一部として取り組んでいる会社が増えています。
私たちは2019年、HGF遺伝子治療用製品が承認されたことにより、世界からも注目されることが増えました。そして2020年、Emendo Biotherapeuticsを完全子会社化し、これから世界に打って出るということで、私たちのような会社でもSDGsのように社会的な責任を果たしていくという大きな目標を掲げていいのではないかと思っています。
アンジェスの経営理念
当社は経営理念として、「治療法がない疾病分野や難病、希少疾患などを対象にした革新的な遺伝子医薬の開発・実用化を通じて、人々の健康と希望にあふれた暮らしの実現に貢献する」を掲げていますが、これはSDGsのゴールの1つである「すべての人に健康と福祉を」につながると考えています。
希少疾患とは?①
希少疾患とは、通常、糖尿病や心疾患などのより一般的な疾患と比較して患者数が極めて少ない疾患と定義され、多様性のある疾患群を言います。重度で慢性的な症状である傾向があり、多くの場合、進行性かつ衰弱性で生命を脅かす疾患です。
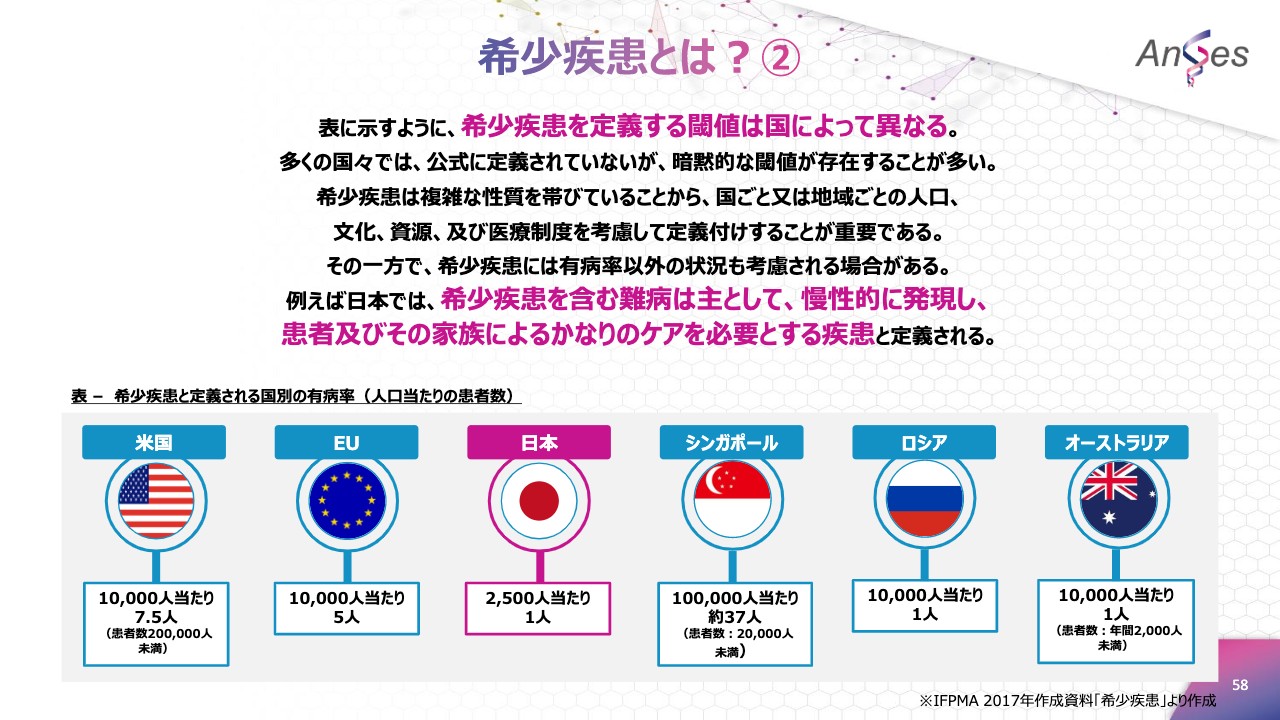
希少疾患とは?②
スライドの表に示していますように、希少疾患を定義する基準値は国によって異なります。日本では「希少疾患を含む難病は主として慢性的に発現し、患者およびその家族によるかなりのケアを必要とする疾患」とされ、「2,500人当たり1人の有病率」が希少疾患と定義されています。
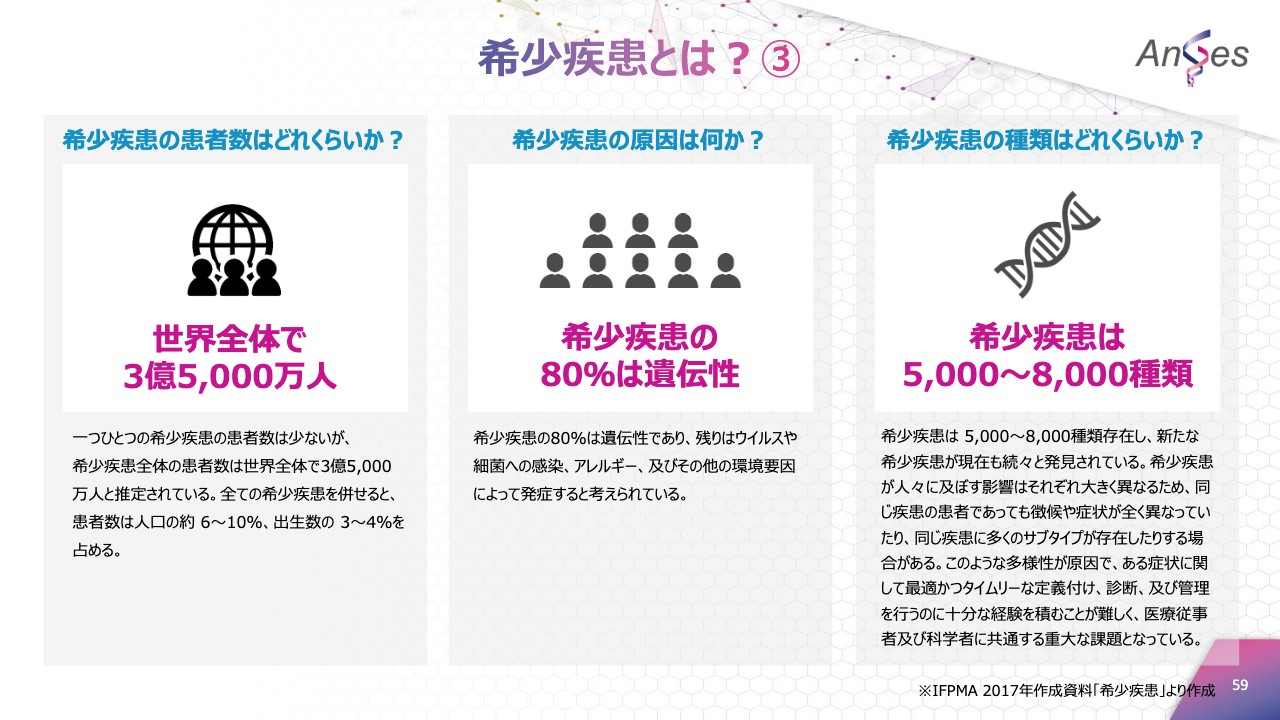
希少疾患とは?③
一つひとつの希少疾患の患者数は少ないですが、希少疾患全体の患者数は世界全体で3億5,000万人。その80パーセントが遺伝性であり、また、希少疾患の種類は5,000種類から8,000種類存在しています。
私たちの希少疾患への取り組み
当社は経営理念にも掲げていますとおり、希少疾患の治療に取り組んでまいりました。1つは、ムコ多糖症Ⅵ型治療薬「ナグラザイム」です。ムコ多糖症Ⅵ型とは、遺伝的な要因で体内の酵素が生まれつき欠損または機能低下し、骨の形成や特異な顔つき、筋肉の膠着や関節が固いといったものが重い症状として現れる、日本国内での患者は9名とごく珍しい遺伝病です。
当社は2008年から2019年に、ムコ多糖症Ⅵ型治療薬「ナグラザイム」を販売していました。現在は国内の製造販売権をバイオマリン社日本法人に承継しています。
また、もう1つ。慢性動脈閉塞症を対象とした、HGF遺伝子治療用製品「コラテジェン」です。慢性動脈閉塞症の潰瘍は、血管が完全に詰まり、血流が遮断され、栄養や酸素の不足によりちょっとした傷でも治癒できず、虚血性の潰瘍や壊疽が起こる状態で、下肢切断を余儀なくされることもある重篤な病態です。
先ほども説明いたしましたが、当社は2019年、世界で初めてプラスミドDNAを用いたHGF遺伝子治療用製品「コラテジェン」の製品化に成功いたしました。
希少疾患への新しい挑戦
新しい挑戦として、先進のゲノム編集技術を有するEmendo Biotherapeuticsを子会社化したことにより、遺伝性希少疾患へ挑戦してまいりたいと思います。
遺伝性希少疾患の解決実現を目指して
遺伝性希少疾患の解決実現を目指して、グローバル基準でのガバナンス体制、また、さらなる希少疾患への研究・開発プロジェクト化を進めてまいります。こうした動きがSDGsのゴール実現へつながるものと信じています。私からの説明は以上となります。今後もご支援賜りたく存じます。ご清聴ありがとうございました。