2020年11月4日に行われた、JCRファーマ株式会社2021年3月期第2四半期決算説明会の内容を書き起こしでお伝えします。
スピーカー:JCRファーマ株式会社 代表取締役 会長兼社長 芦田信 氏\nJCRファーマ株式会社 上席執行役員 葉口明宏 氏\nJCRファーマ株式会社 執行役員 谷澤和紀 氏
2021年3月期第2四半期決算説明会
芦田信氏:JCRファーマ株式会社の芦田信です。本日は、JCRファーマ2021年3月期第2四半期の決算説明会の動画をご覧いただき、誠にありがとうございます。投資家のみなさまにおかれましては、平素より当社への格別のご理解とご支援を賜り、誠にありがとうございます。
本日の説明会では、2021年3月期第2四半期累計の決算概要、研究開発の状況説明について、後ほど各担当者からご説明いたします。
私から、はじめにライソゾーム病治療薬に関するライセンス契約についてお話をいたします。
今年5月に開催した決算説明会におきまして、上期中に契約できる見込みであると申し上げましたが、コロナ禍において対面での交渉を行うことが困難になったため、我々が当初想定していたよりも交渉が進捗いたしませんでした。
また、後ほどお話しいたしますが、アストラゼネカ社との新型コロナワクチン原液の国内製造に関する協議を同じ時期に行うことになり、関連する人員がその対応にあたったことなどもあり、9月末までの契約締結には至りませんでした。
このことにより、業績予想を修正させていただき、株主・投資家のみなさまへご心配をお掛けしたことにつきまして、深くお詫び申し上げます。
さて、研究開発においては、「JR-141」「JR-171」などの新薬開発はスケジュールどおりに進捗しています。「JR-141」については、9月末に日本での製造販売承認申請を行いました。ブラジルでも本年中の製造販売承認申請に向け、確実に進捗しています。
また、グローバルでの臨床第3相試験開始も目前に迫っています。「JR-171」については、グローバルでの臨床第1/2相試験が、7月に日本で治験届が受理され、10月にはブラジルでも治験届が受理されました。この後、アメリカを含め臨床試験を進めてまいります。
これら新薬開発は、極めて順調に進捗していますので、ライソゾーム病治療薬に関するライセンス契約は、今期中には契約が締結できると思っています。
次に、アストラゼネカ社との新型コロナウイルスワクチンの原液の国内製造に関する件についてお話しいたします。
すでにお知らせしたとおり、アストラゼネカ社が開発中のアデノウイルスベクターを用いたCOVID-19に対するワクチンについて、日本国内における原液製造に関し、当社が製造を受託することについて協議しています。
このワクチン原液製造については、当社が有しているバイオ医薬品製造技術・遺伝子治療技術を高く評価していただいたものと考えており、これらの技術を活用して、一日も早くこのワクチンを日本国内に安定供給できるよう、全社を挙げて鋭意取り組んでおり、正式に決定した際には速やかに原液の生産を開始いたします。
また、このワクチンを供給するため、医薬品の流通を安定的に支える社会インフラ企業であるメディパルホールディングスにも事業参画していただくことになります。
新型コロナウイルスの影響による経済活動は回復に向けて動いていますが、感染拡大の脅威は未だ解決されていません。早期収束と人々の健康に貢献できるよう取り組んでまいります。
この上期は、新型コロナウイルスの影響により、ライセンス契約がずれ込んだり、ワクチンの原液製造の協議を行うなど、当初予期していなかった事象が発生しましたが、現在開発中のライソゾーム治療薬を含め、すべての研究開発は順調に推移しており、また、将来に向けての遺伝子治療など、開発をさらに進めるために研究体制の充実を図っています。また、将来新薬の商業生産を担う製造設備の増強についても検討を進めています。
今後とも、投資家のみなさまのご理解とご支援を賜りたく、よろしくお願い申し上げます。
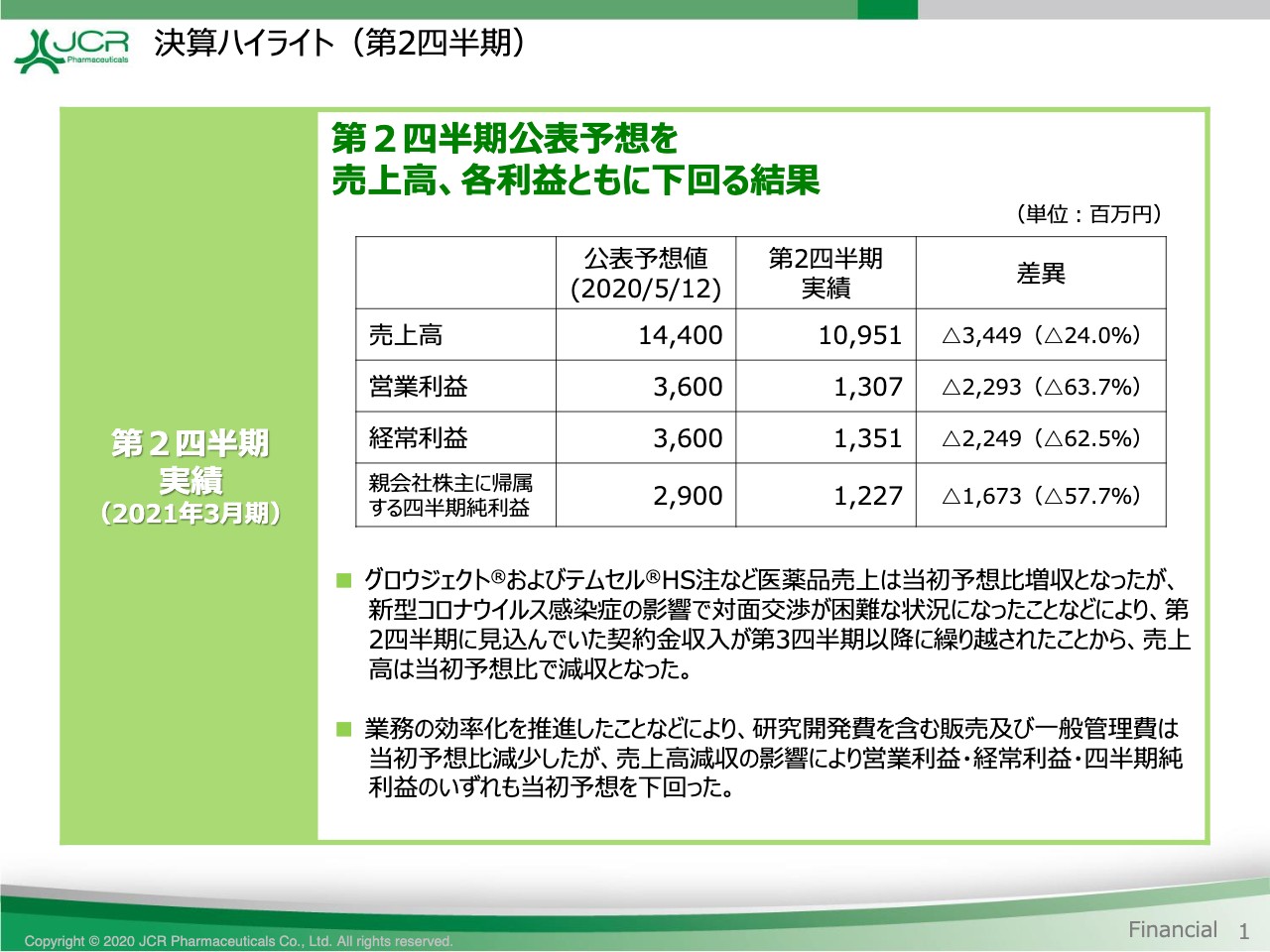
決算ハイライト(第2四半期)
葉口明宏氏:管理本部の葉口です。2021年3月期第2四半期の決算概要につきまして、ご報告申し上げます。
まず、当初予想との比較をご覧ください。売上高は当初予想に比べて24.0パーセント減少いたしました。その結果、109億5,100万円を計上しています。「グロウジェクト®」や「テムセル®」などの医薬品の売上高は当初予想比で増収となりましたが、新型コロナウイルス感染症の影響で対面交渉が困難となったことなどにより、第2四半期に見込んでいた契約金収入が第3四半期以降に繰り越されたことが主な要因です。
利益面におきましては、業務の効率化を推進したことなどにより、研究開発費を含む販売費及び一般管理費は予想に比べて減少しましたが、売上高減収の影響により営業利益・経常利益・四半期純利益のいずれも当初予想を下回る結果となりました。
なお、「JR-141」(ハンター症候群治療薬)をはじめとする、ライソゾーム病治療薬の研究開発は順調に進捗しています。導出契約につきましても、当期中の合意が見込まれているため、通期の業績予想につきましては変更ございません。
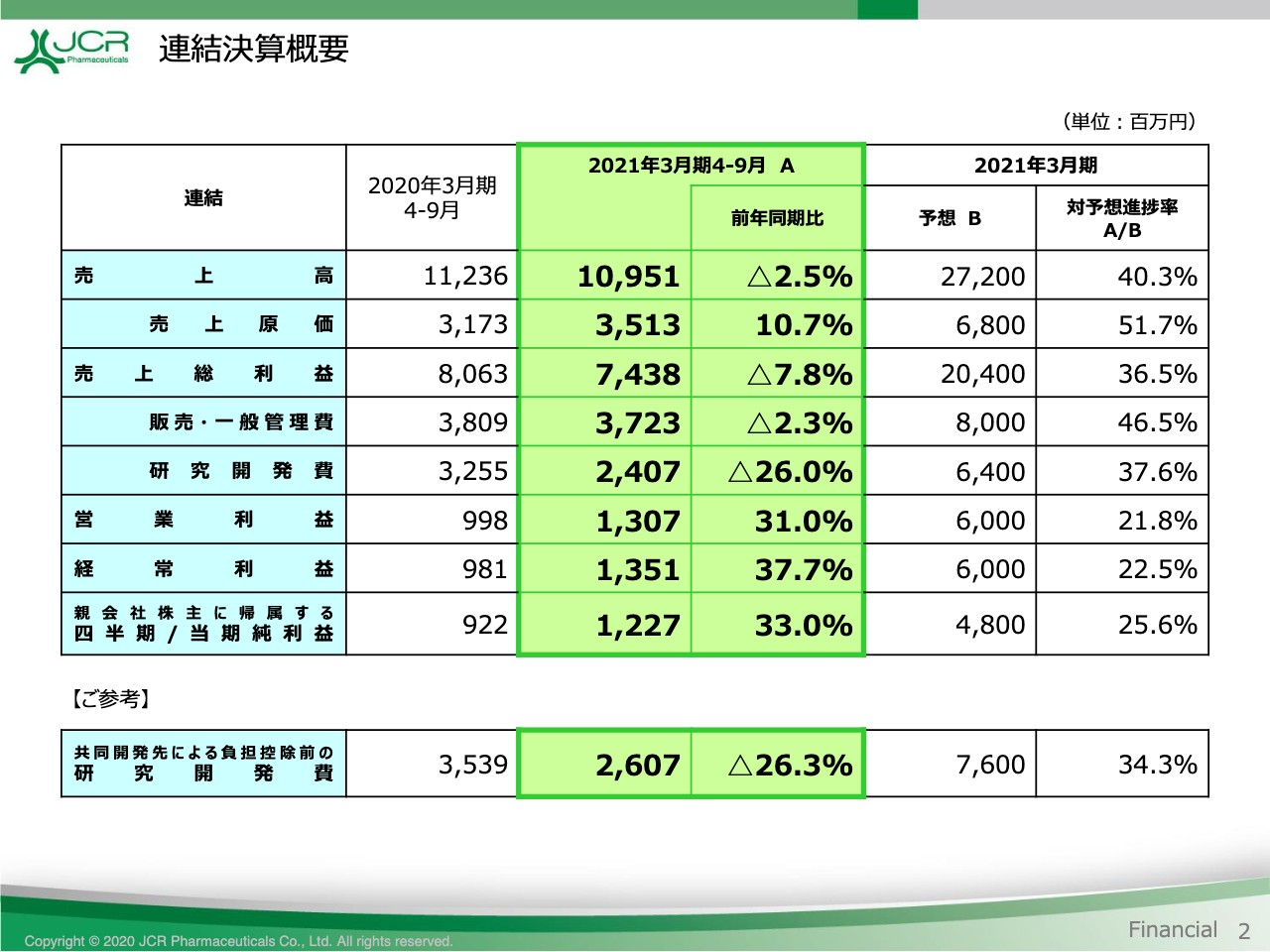
連結決算概要
次に、前期との比較をご覧いただきます。このページでは、中央から左には当第2四半期の数値と前期比を、右には通期予想に対する進捗を表示しています。
売上高は、当初予想比では24.0パーセントの減収となりましたが、前期比では2.5パーセントの減収にとどまっています。契約金収入が減収したことなどにより、売上原価率は3.5ポイント上昇して、32.1パーセントとなり、売上総利益は前年に比べて7.8パーセント減少して、74億3,800万円となりました。
一方、販売・一般管理費は、新型コロナウイルス感染症への対応を含めて、業務の効率化に取り組んだ結果、2.3パーセント減少して37億2,300万円。研究開発費は、前期におきましてはアーマジェン社への支払を計上いたしていたため、当期においては前期比で26.0パーセント減少して、24億700万円という結果です。
以上、売上高は減収となりましたが、営業利益・経常利益・四半期純利益のいずれも30パーセント以上の増益を確保することができました。通期の予想につきましては、先ほど申し上げましたとおり、当初の予想に変更はございません。
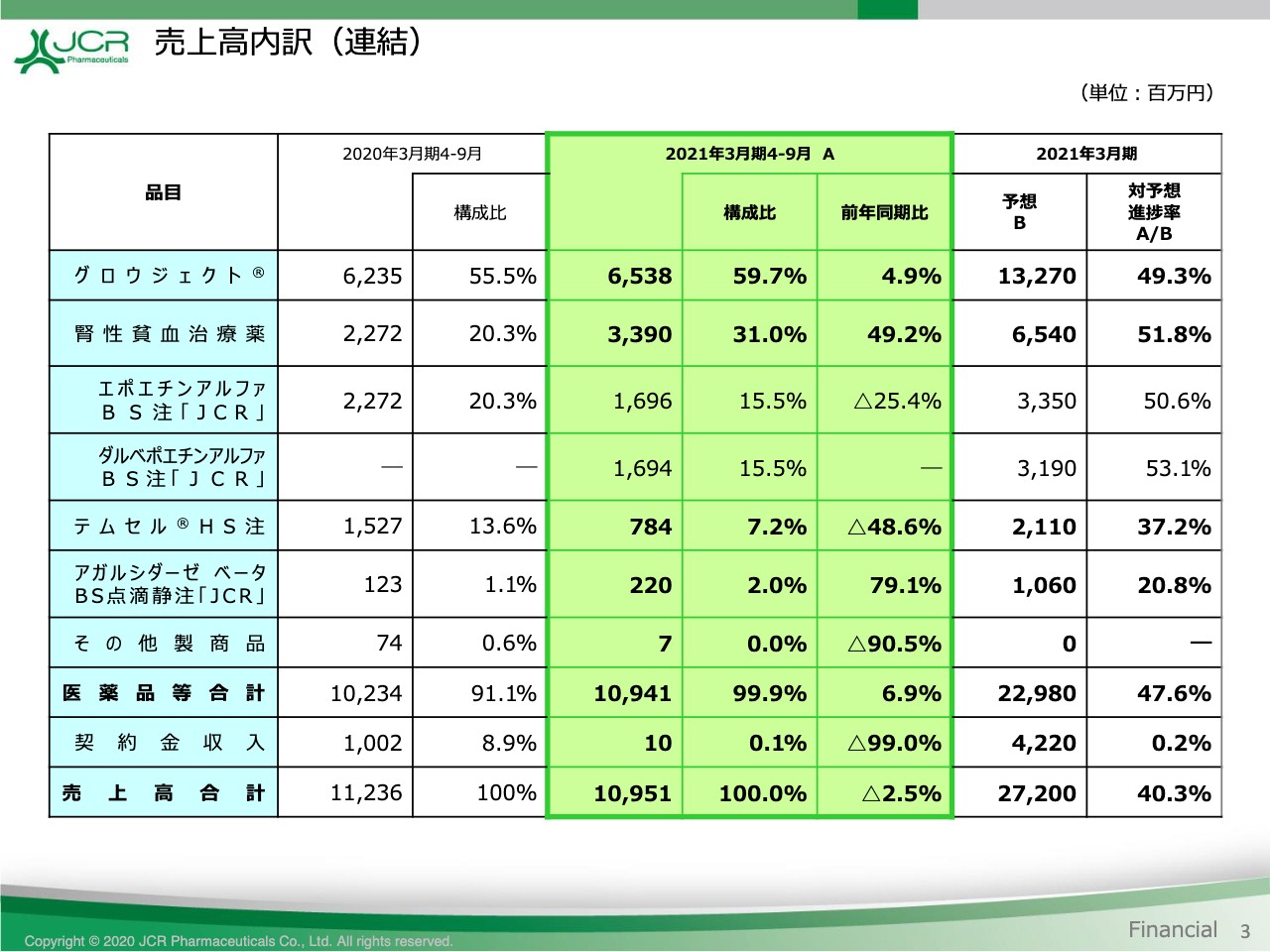
売上高内訳(連結)
続いて、売上高の内訳をご覧いただきます。このページでは、売上高の内訳につきまして、中央から左に前年との比較、右に通期予想に対する進捗を表示しています。
本年4月に薬価改定がございましたが、販売数量の増加により、成長ホルモン製剤「グロウジェクト®」、腎性貧血治療薬およびファブリー病治療薬「アガルシダーゼ ベータBS」は、いずれも前期に比べて増収となりました。
腎性貧血治療薬につきましては、昨年11月に発売した「ダルベポエチンアルファBS」の販売が好調に推移したことにより、「エポエチンアルファBS」との合計で、前期に比べて49.2パーセントの増収となっています。
「テムセル®」は在庫確保のために実施した供給制限の影響もあり、48.6パーセントの減収となりましたが、医薬品合計では前期比6.9パーセント増加して109億4,100万円となっています。
一方、冒頭に申し上げたとおり、第2四半期に見込んでいた契約金収入が第3四半期以降に繰り越されたことから、売上高合計では前期比2.5パーセント減の109億5,100万円を計上いたしています。
以上、売上高の内訳をご覧いただきました。
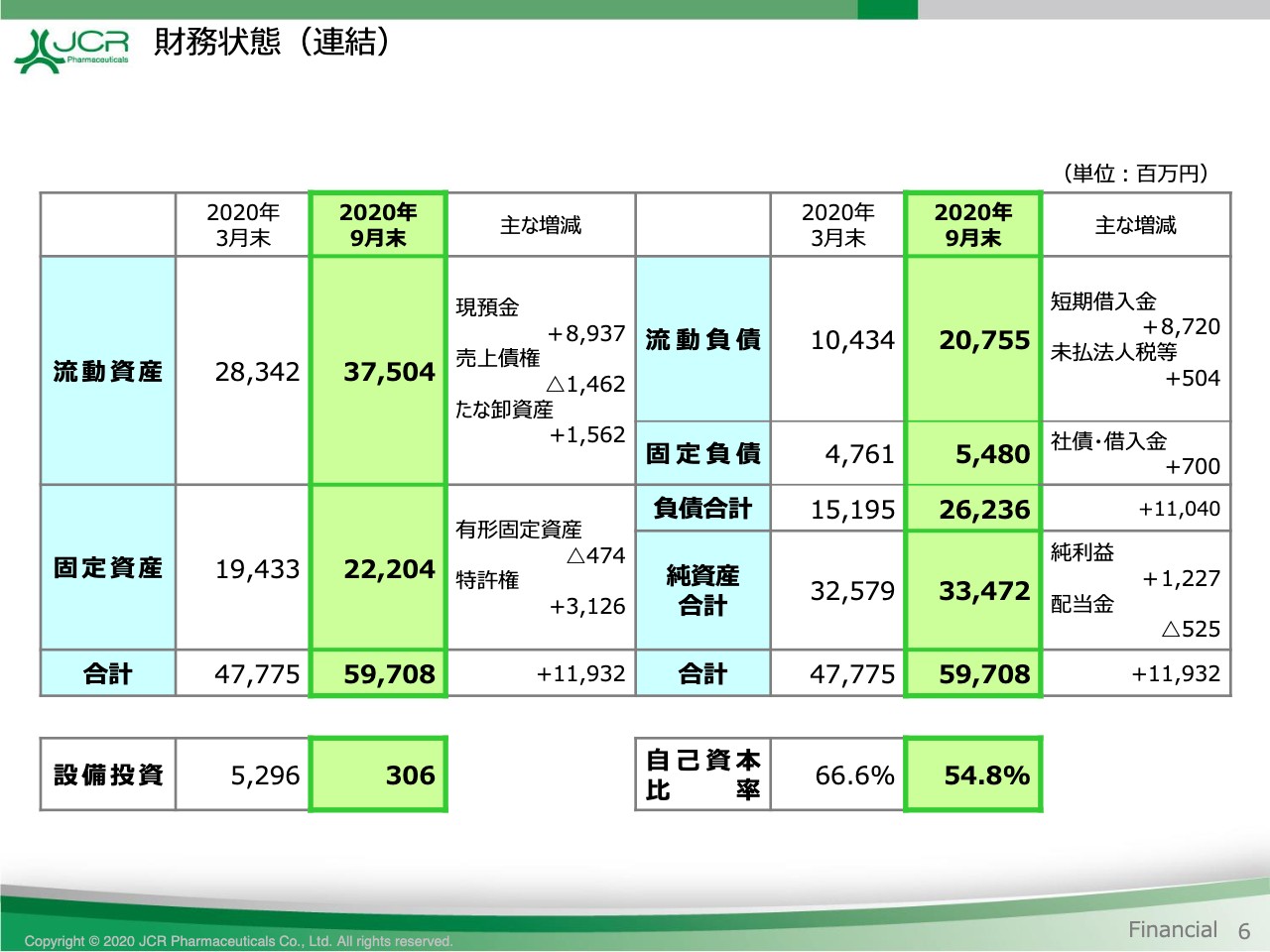
財務状態(連結)
続きまして、貸借対照表をご覧いただきます。6ページです。当第2四半期におきましては、2つのトピックスがございます。
1つ目は、新型コロナウイルス感染症への対応として手元資金を積み増したことです。これにより、現預金及び借入金がそれぞれ約90億円増加いたしました。現時点までにライソゾーム病治療薬の導出交渉以外には、すなわち生産・研究開発・営業などの各活動には、影響を受けていません。ただし、世界経済の見通しが不透明感を増す中、今後のグローバル展開に向けて手元資金の充実を図ったものです。
2つ目は、特許権の計上です。本年4月にアーマジェン社を子会社化したことに伴い、特許権31億2,600万円を計上しています。これらの結果、資産合計は前期末比で119億3,200万円増加して、597億800万円となっています。自己資本比率は11.8ポイント低下して、54.8パーセントとなりました。
貸借対照表につきましては、以上です。
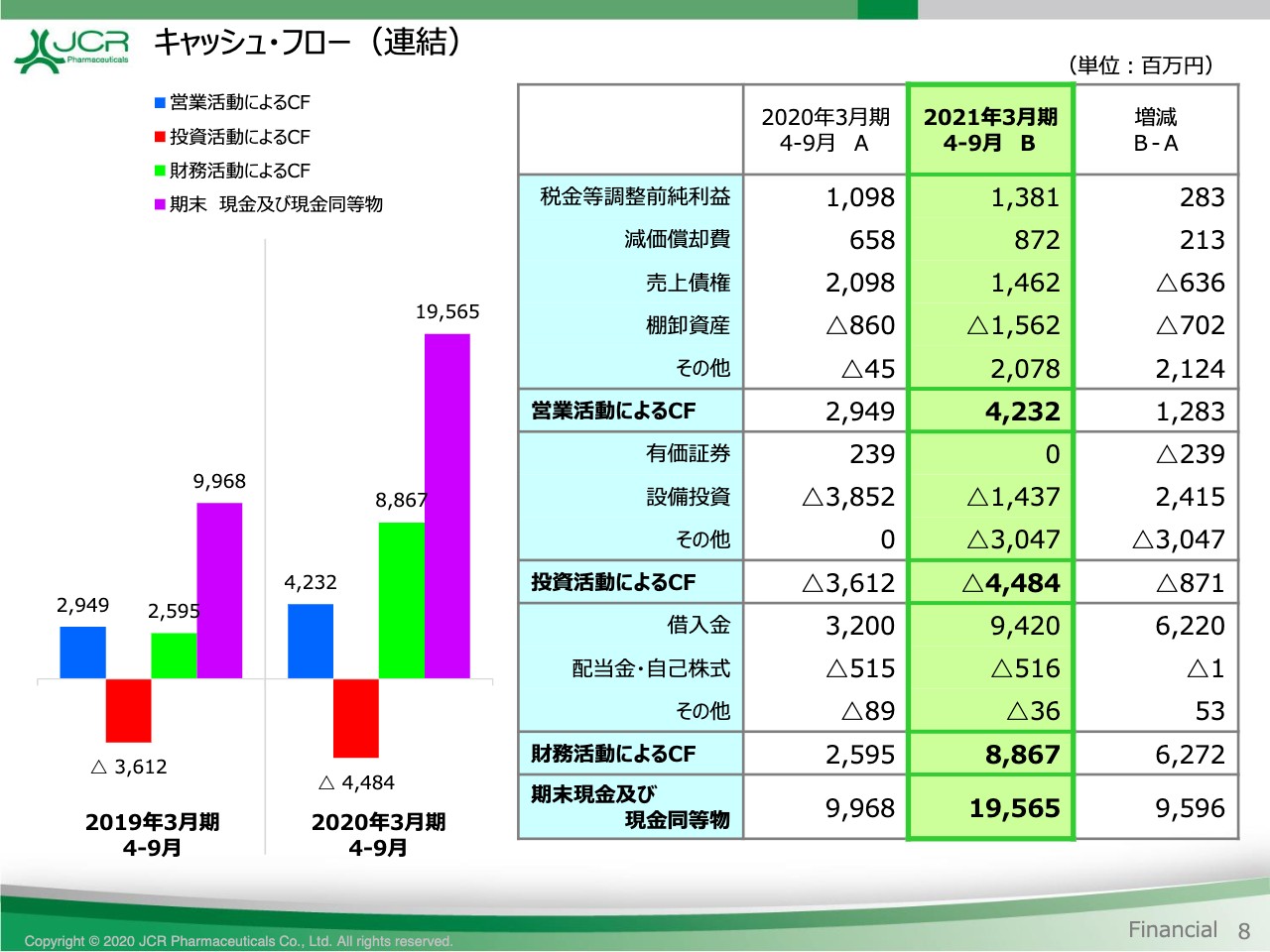
キャッシュ・フロー(連結)
最後に、キャッシュ・フローをご覧いただきます。8ページです。営業活動によるCFは、前期に比べて12億円増加して、42億3,200万円の収入となりました。投資活動によるCFは、設備投資及び特許権の取得により44億8,400万円の支出となっています。一方、財務活動によるCFは、手元資金充実のために借入を実行したことに伴い、88億6,700万円の収入となりました。
これらの結果、9月末の現金及び現金同等物は、前期末に比べて約96億円増加して195億6,500円となっています。
以上、当第2四半期の経営成績及び財政状態につきまして、ご覧いただきました。ご清聴、ありがとうございました。
開発パイプライン
谷澤和紀氏:開発本部の谷澤です。私から、研究開発の進捗についてご報告を申し上げます。こちらにお示ししていますのが、開発パイプラインになります。
緑色でお示ししているのがライソゾーム病治療酵素製剤、紫色がタンパク質製剤、オレンジ色が再生医療等製品となります。
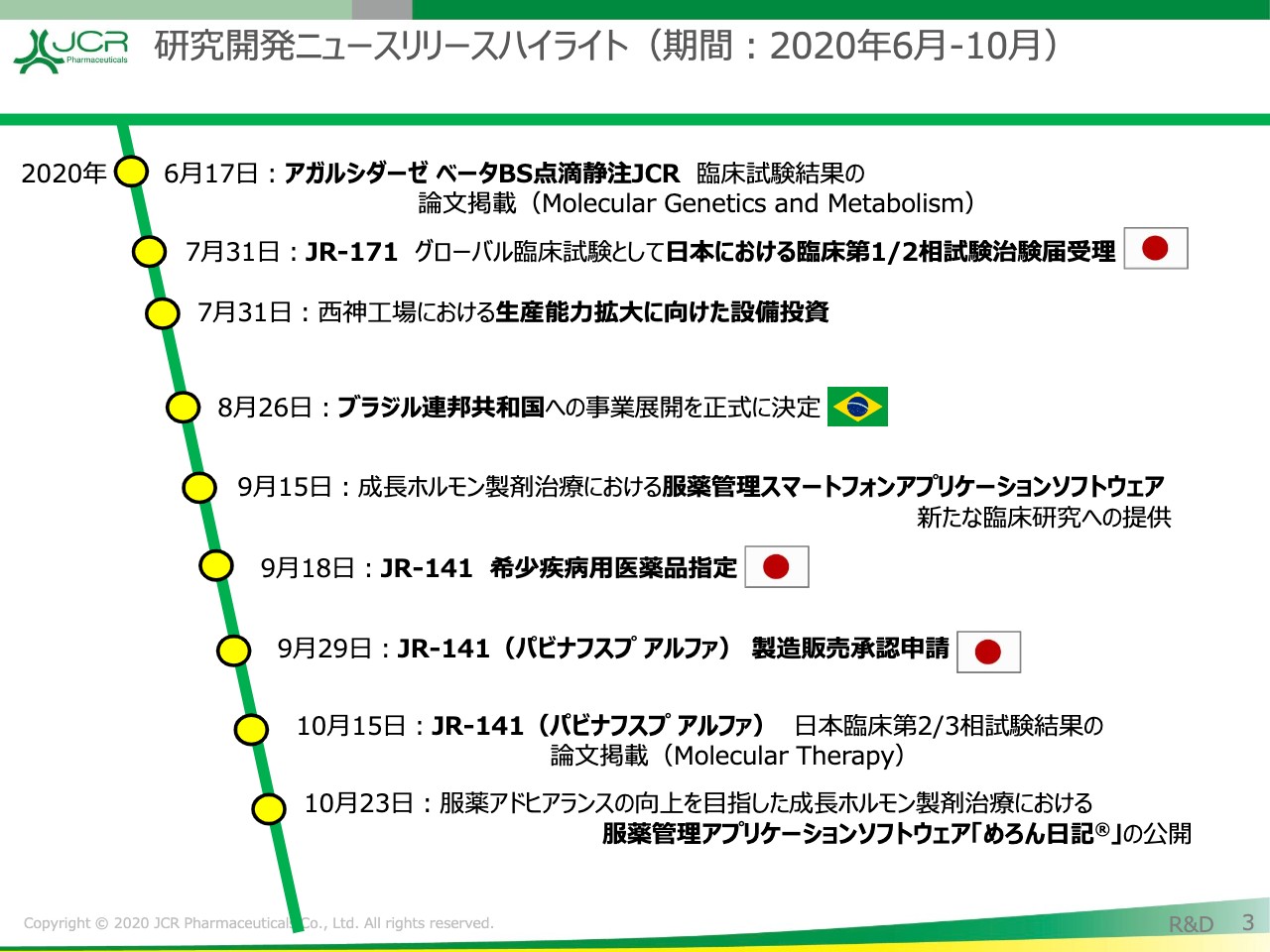
研究開発ニュースリリースハイライト(期間:2020年6月‐10月)
研究開発のニュースリリースのハイライトをお示ししています。7月31日には、「JR-171」の日本における臨床第1/2相試験治験届が受理されました。また、8月にはブラジルへの事業展開を正式に決定いたしました。9月29日には「JR-141」の製造販売承認申請を行っています。
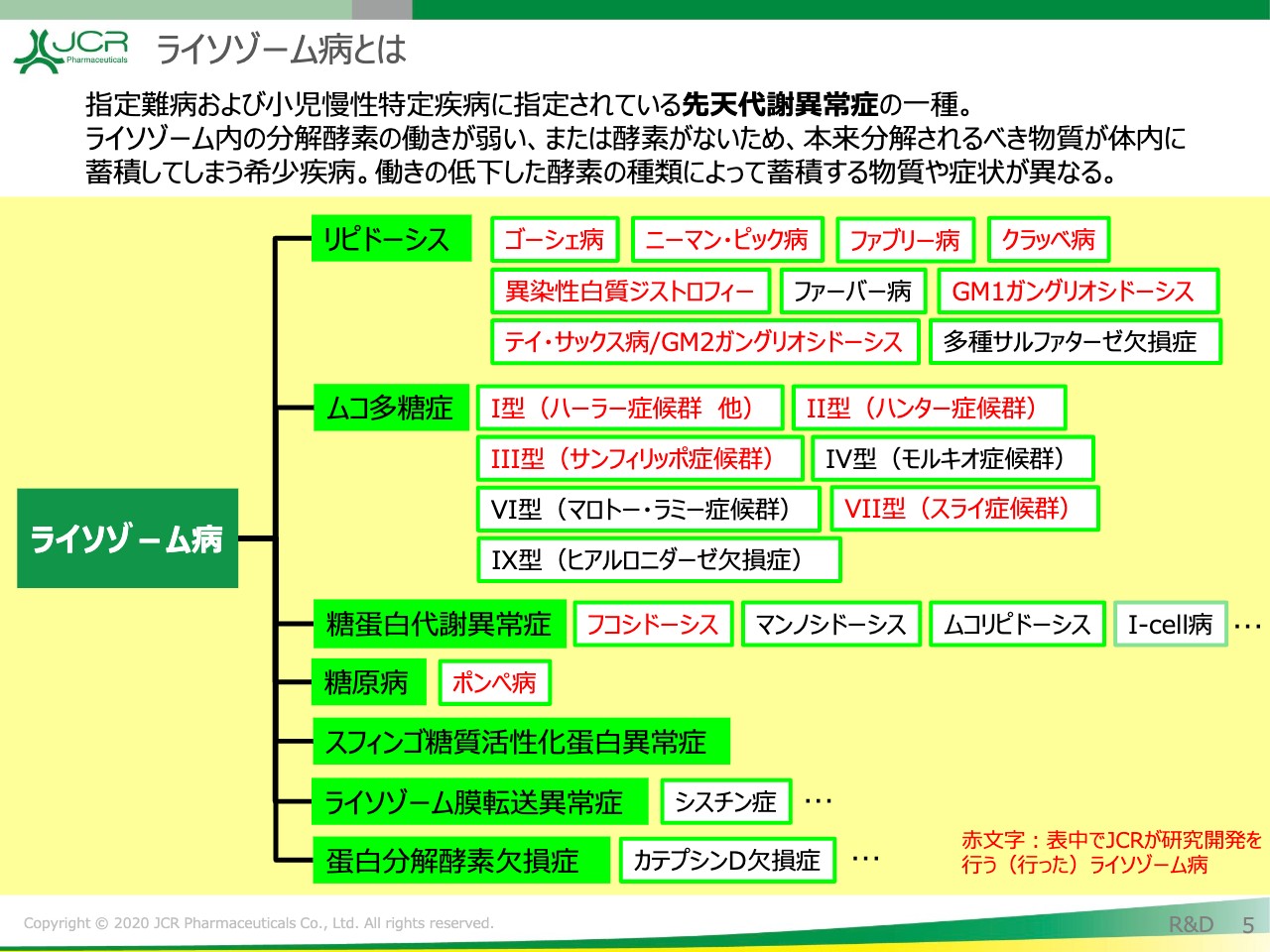
ライソゾーム病とは
ここからは、「JR-141」の開発状況についてご説明を申し上げます。
こちらにお示ししていますライソゾーム病のうち、赤字でお示ししているものが、現在JCRが取り組んでいるライソゾーム病の疾患になります。このうち、ムコ多糖症Ⅱ型(ハンター症候群)について、現在「JR-141」の開発を行っています。
JR-141 開発状況①
ムコ多糖症Ⅱ型は、こちらにお示ししているとおり、「Iduronate-2-sulfatase」の欠損により発症するX染色体連鎖劣性遺伝性疾患です。へパラン硫酸やデルマタン硫酸が全身の組織、あるいは中枢に蓄積することにより、こちらに示したさまざまな臨床症状が発症いたします。
ハンター症候群におけるアンメットメディカルニーズ
ハンター症候群では、3分の2の患者さんが知的障害を伴うといわれていて、これら中枢神経症状が患者のQOLを大きく低下させています。
ここに関して、現在は治療法がないことが、大きなアンメットメディカルニーズになっていまして、JCRでは、これを「JR-141」の開発で解決すべく取り組んでいます。
今回、我々が着目いたしましたのは、脳実質内に蓄積したヘパラン硫酸を減少させることが、中枢神経症状の改善に向けた直接的アプローチとして重要と考えています。
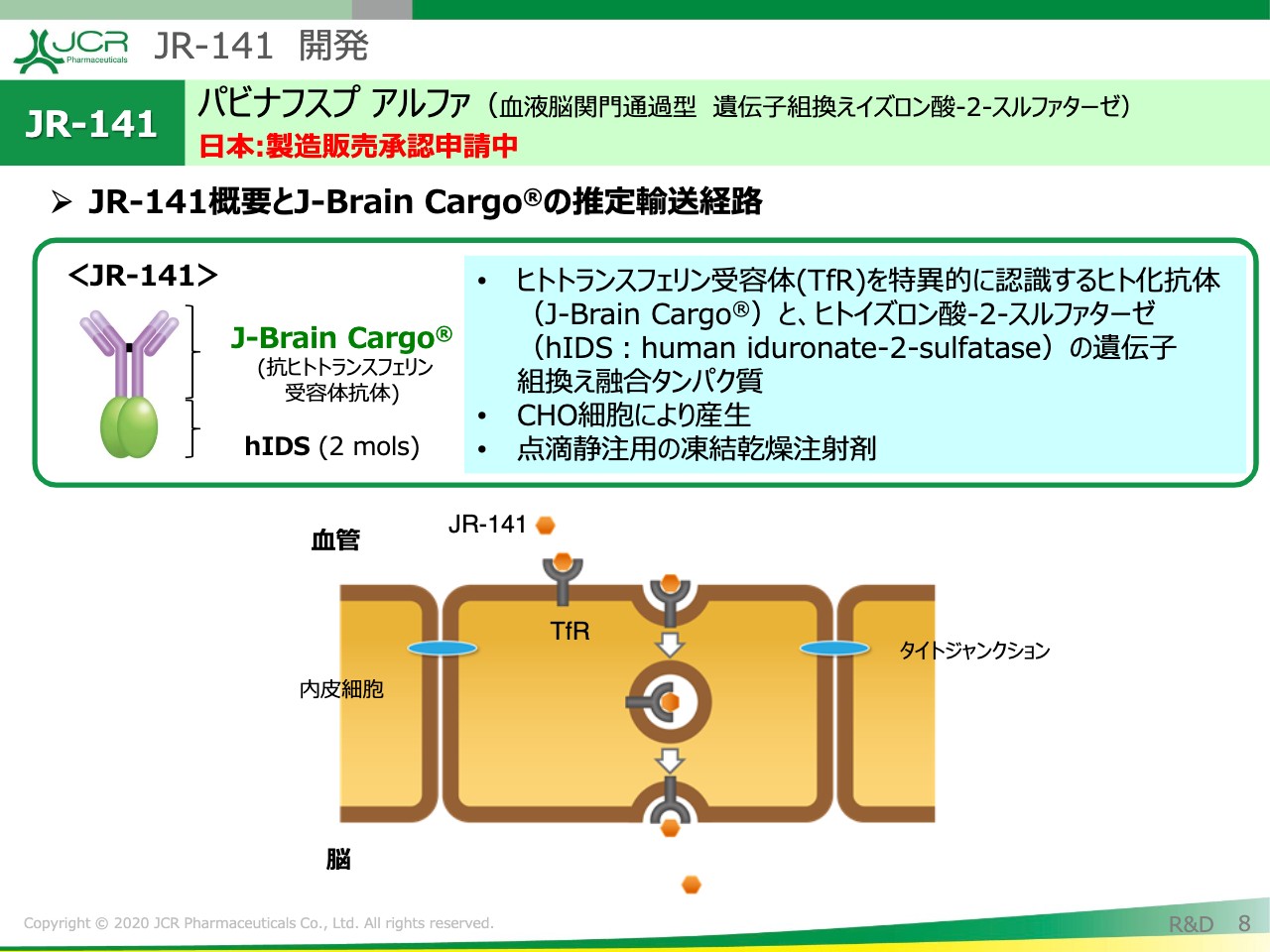
JR-141 開発
「JR-141」は国際一般名として、「パビナフスプ アルファ」という名前をいただいています。「JR-141」は、「J-Brain Cargo®」部分、抗ヒトトランスフェリン受容体抗体部分と、2分子のhIDS酵素から成り立っています。
この「JR-141」が、脳毛細血管上の内皮細胞上に発現していますトランスフェリンレセプターと結合し、トランスサイトーシスを経て、脳実質に移行することで、BBB通過能を発揮しています。
JR-141 開発の歴史
「JR-141」の開発は、15年前からすでに行われていまして、非常に長い期間、開発を行っています。ただ、ご覧いただけますように、2017年に臨床第1/2相試験を開始いたしまして、現在2020年に製造販売承認を行えたことは、非常に開発期間としては短いものと我々は認識しています。ここは、患者の方々、あるいは先生方の非常に大きな期待の結果と認識しています。
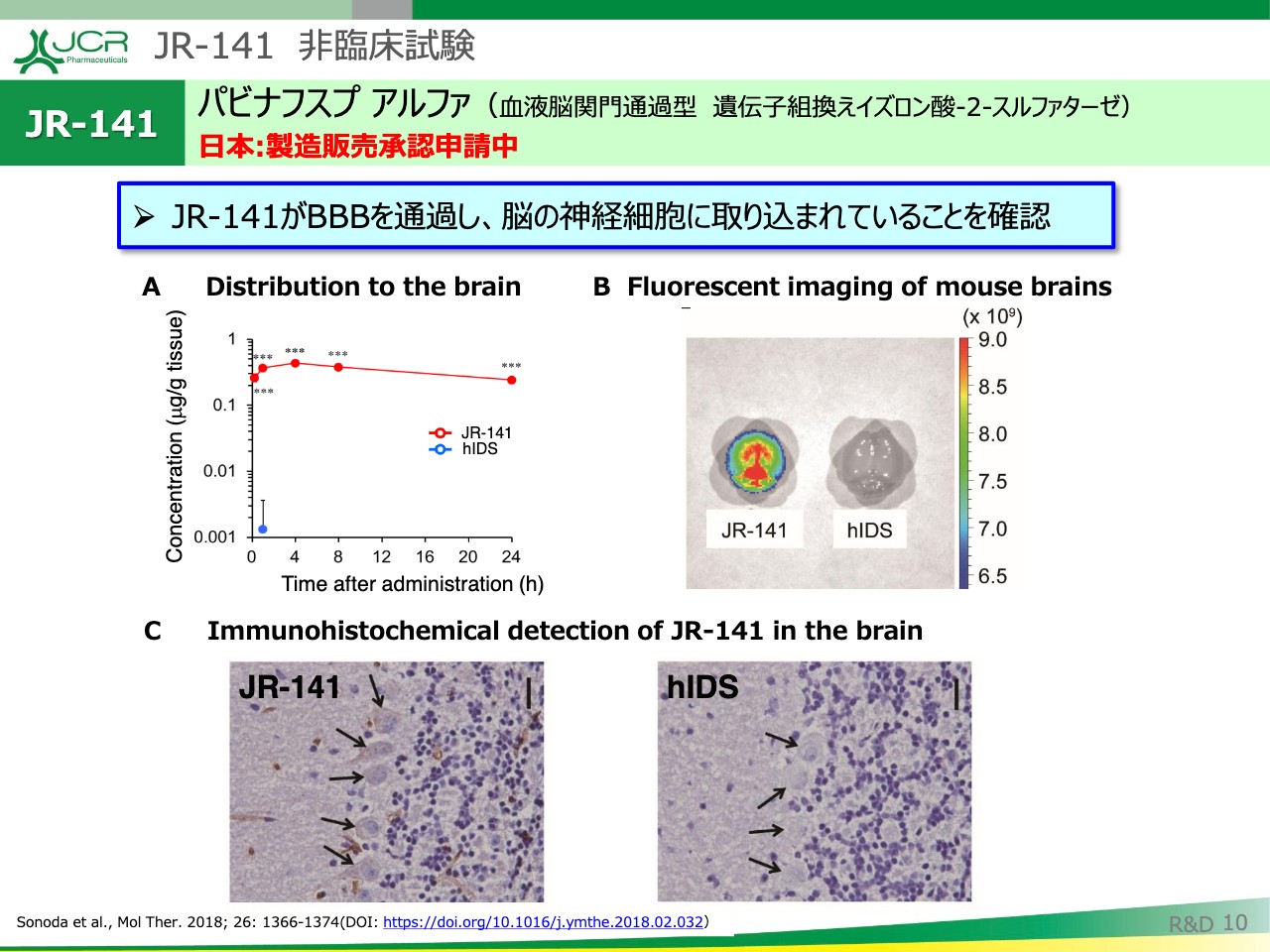
JR-141 非臨床試験①
こちらに非臨床試験の結果をお示ししています。論文化されていますので、詳細はご説明いたしませんが、「JR-141」がBBBを通過して、脳の神経細胞に取り込まれていることが確認できます。
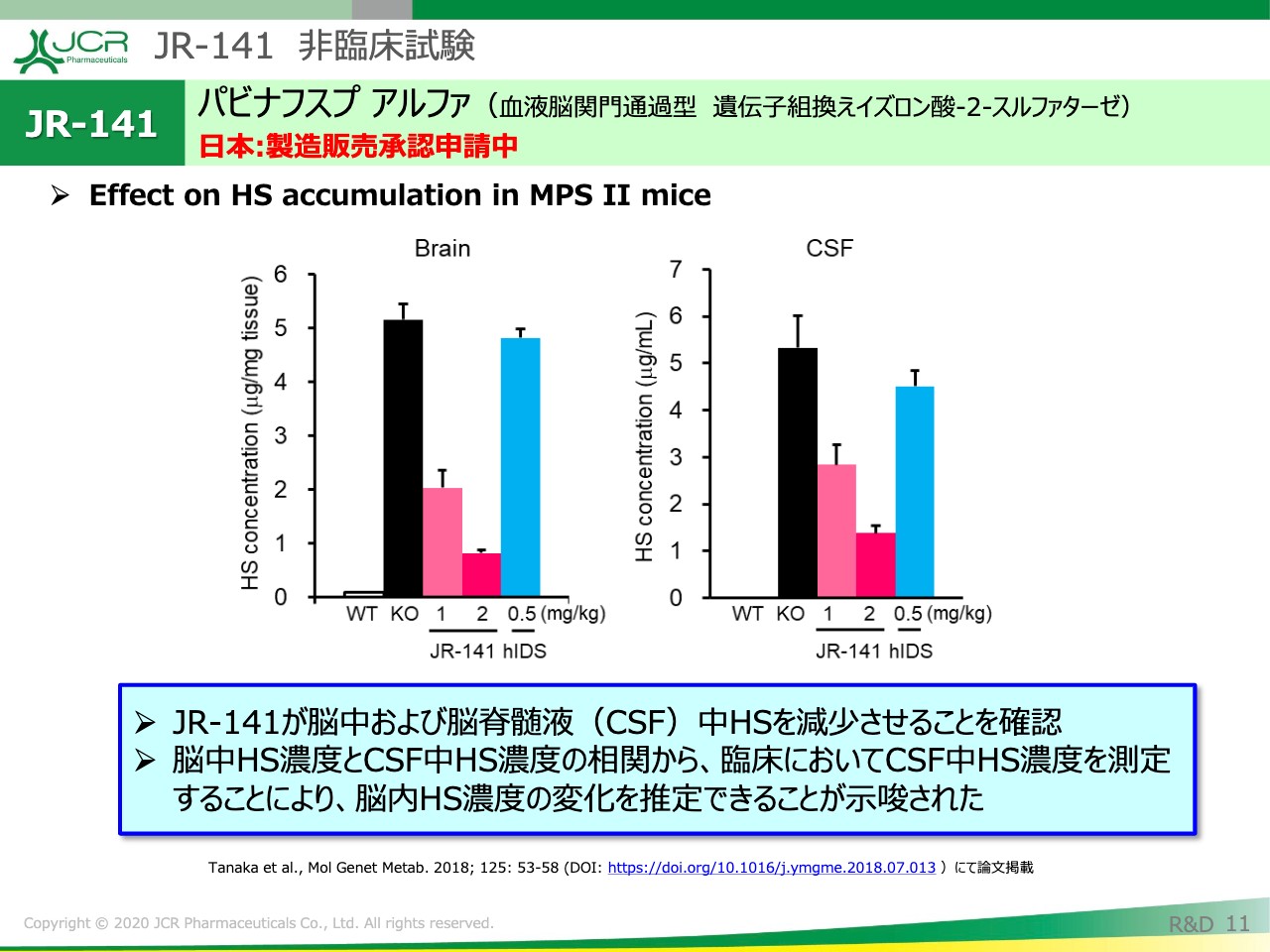
JR-141 非臨床試験②
こちらは、ヘパラン硫酸の減少をKOマウスで確認したものになります。これは、脳の中とCSF中と両方見たものになりますが、容量依存的にヘパラン硫酸が減少している様子がおわかりいただけるかと思います。
また、もう1点補足させていただきますと、脳内の基質の減少とCSF中の基質の減少が、非常に良く相関していることもおわかりいただけるかと思います。
このデータが意味するところとしては、臨床試験で確認された、CSF中のヘパラン硫酸の減少が、脳内の蓄積物質の減少を表していることを示唆するものです。
JR-141 臨床試験(日本)①
ここからは、国内臨床第3相試験の試験概要についてご説明申し上げます。
すでに、第3相試験は完了していて、現在「JR-141-302試験」という継続投与試験で、多くの患者の方が「JR-141」の投与を受けています。主要評価項目は、脳脊髄液中ヘパラン硫酸濃度。副次評価項目として、発達評価、血中・尿中のヘパラン・デルマタンサルフェイトの濃度、あるいは6分間歩行等の検討を行っています。19の全国の施設から、28名の患者の方々にご参加をいただきました。
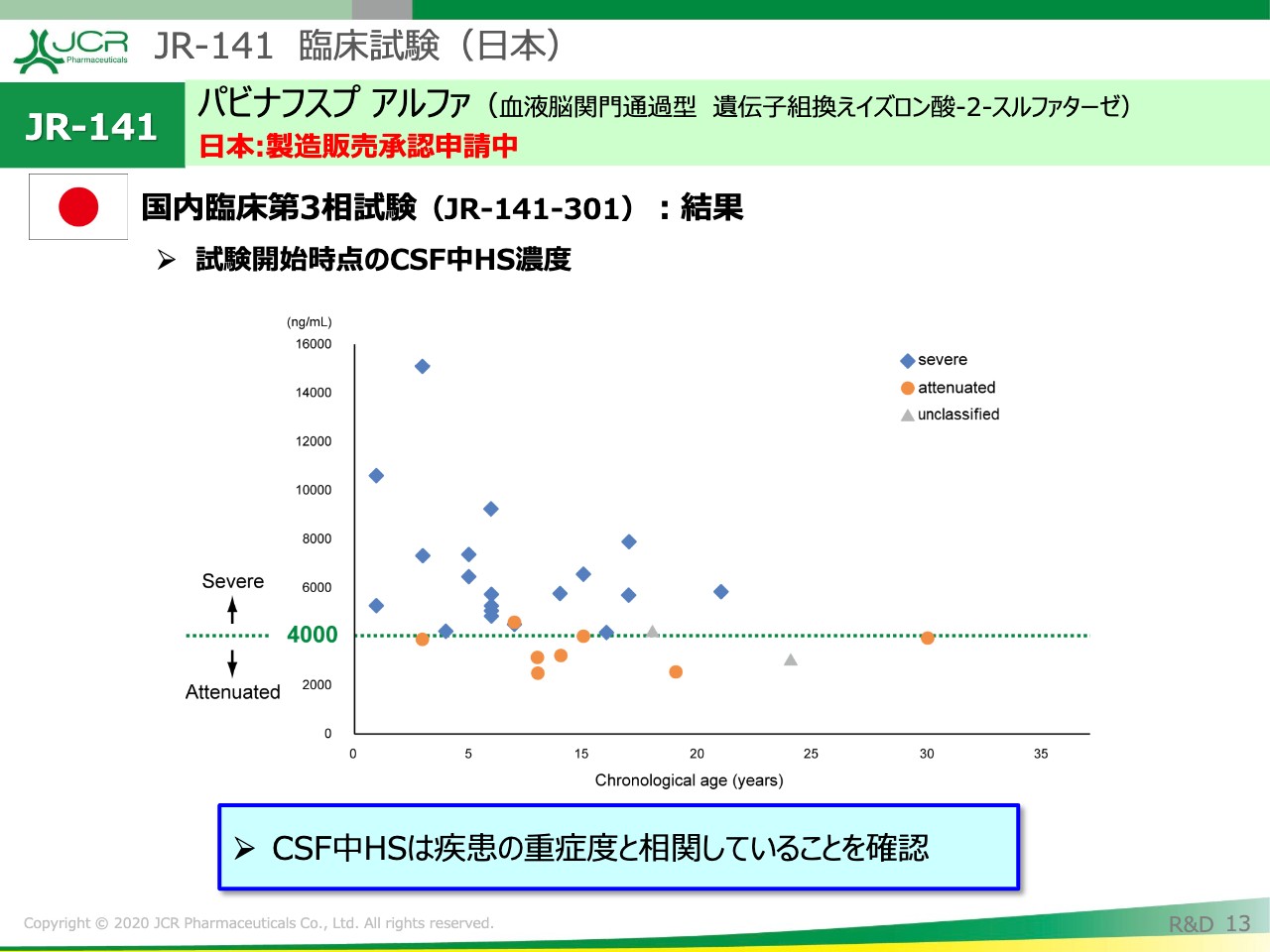
JR-141 臨床試験(日本)②
まず、試験開始時点のCSF中HS濃度をお示ししたいと思います。オレンジのドットが軽症型、青色のドットが重症型の患者の方々のベースラインのデータを示しています。
オレンジの部分が下に集まっていて、だいたい4,000ng/mLラインに重症型をわけるようなカットオフ値が見ていただけるかと思います。このように、CSF中のヘパラン硫酸といいますのは、疾患の重症度とよく相関していることが、この試験を実施する中でわかってまいりました。
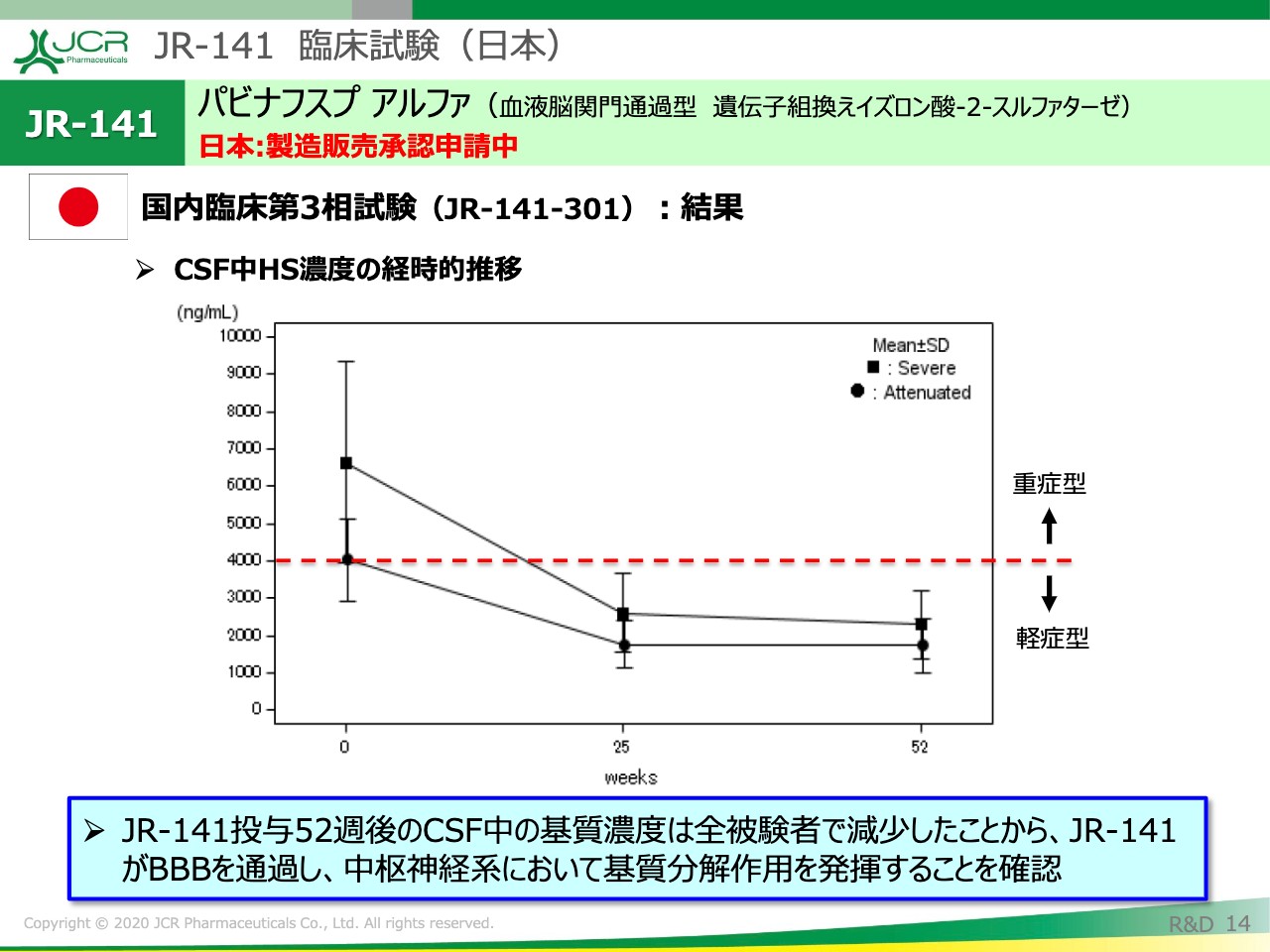
JR-141 臨床試験(日本)③
続きまして、その値が治療後にどうなったかをこちらでお示ししています。四角が重症型、丸が軽症型のデータです。
重症型におきましても、52週にかけて、ヘパラン硫酸の濃度は減少して、最終的には2,000ng/mLの値まで減少しています。これは十分に軽症型のレベルといえるかと思います。
JR-141 臨床試験(日本)④
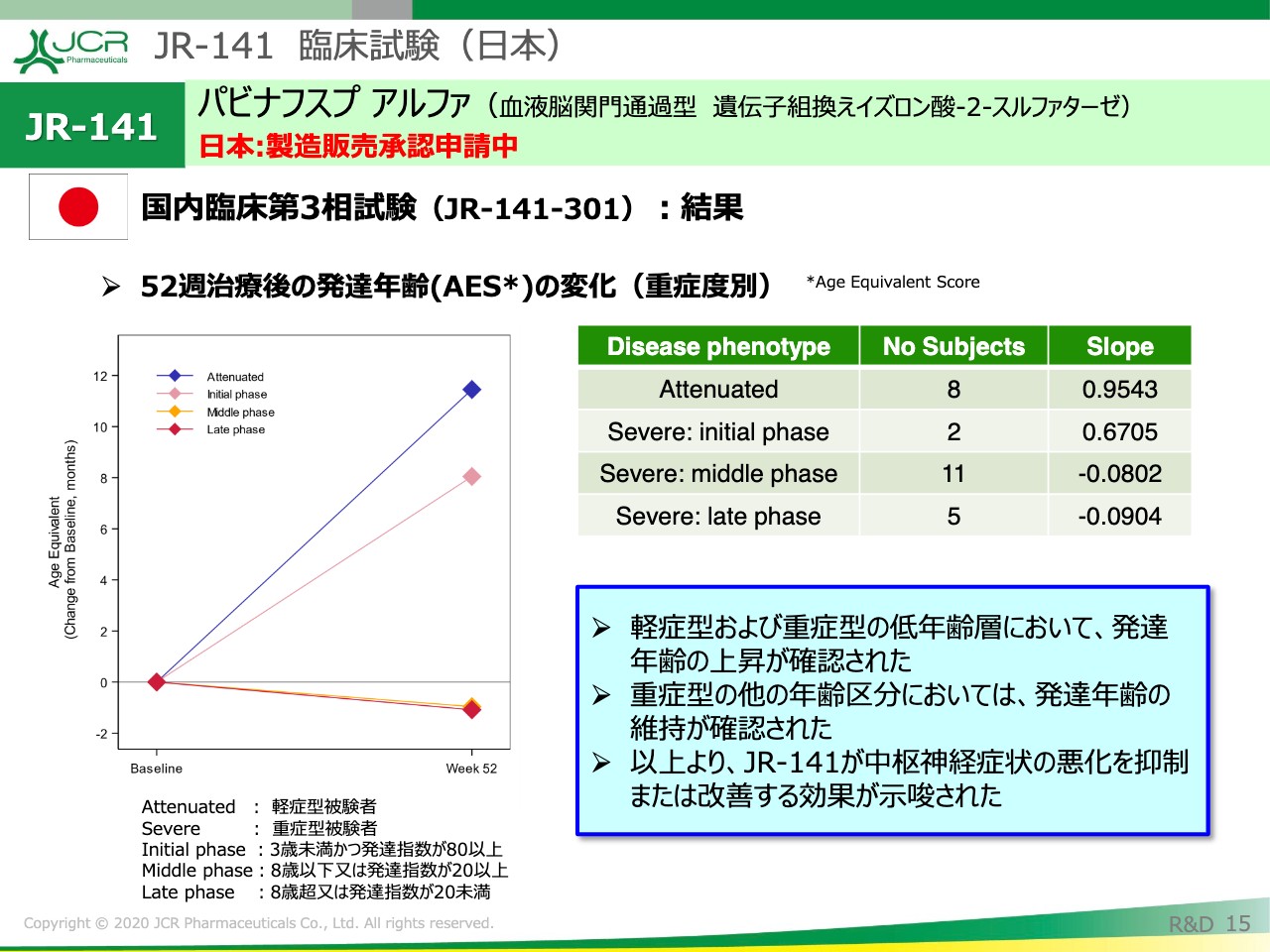
この試験の中では、発達年齢の評価も行っています。左の図を見ていただきたいのですが、一番上の青い線が軽症型患者の結果です。52週、約1年間、12ヶ月の治療をした結果、12ヶ月に近い発達年齢の上昇が認められていますので、この結果としては、正常な発達が認められたと言うことができると思います。
その下の線が、3歳未満の重症患者のデータになります。ご覧いただけますように、12ヶ月の治療後に発達年齢の上昇が認められました。
3歳以上の患者の方々に関しては、すでに開始時点で発達年齢が低下している特徴がございます。その方々に関しては、治療後、その発達年齢が維持された。そういう結果と認識しています。
JR-141 臨床試験(日本)⑤
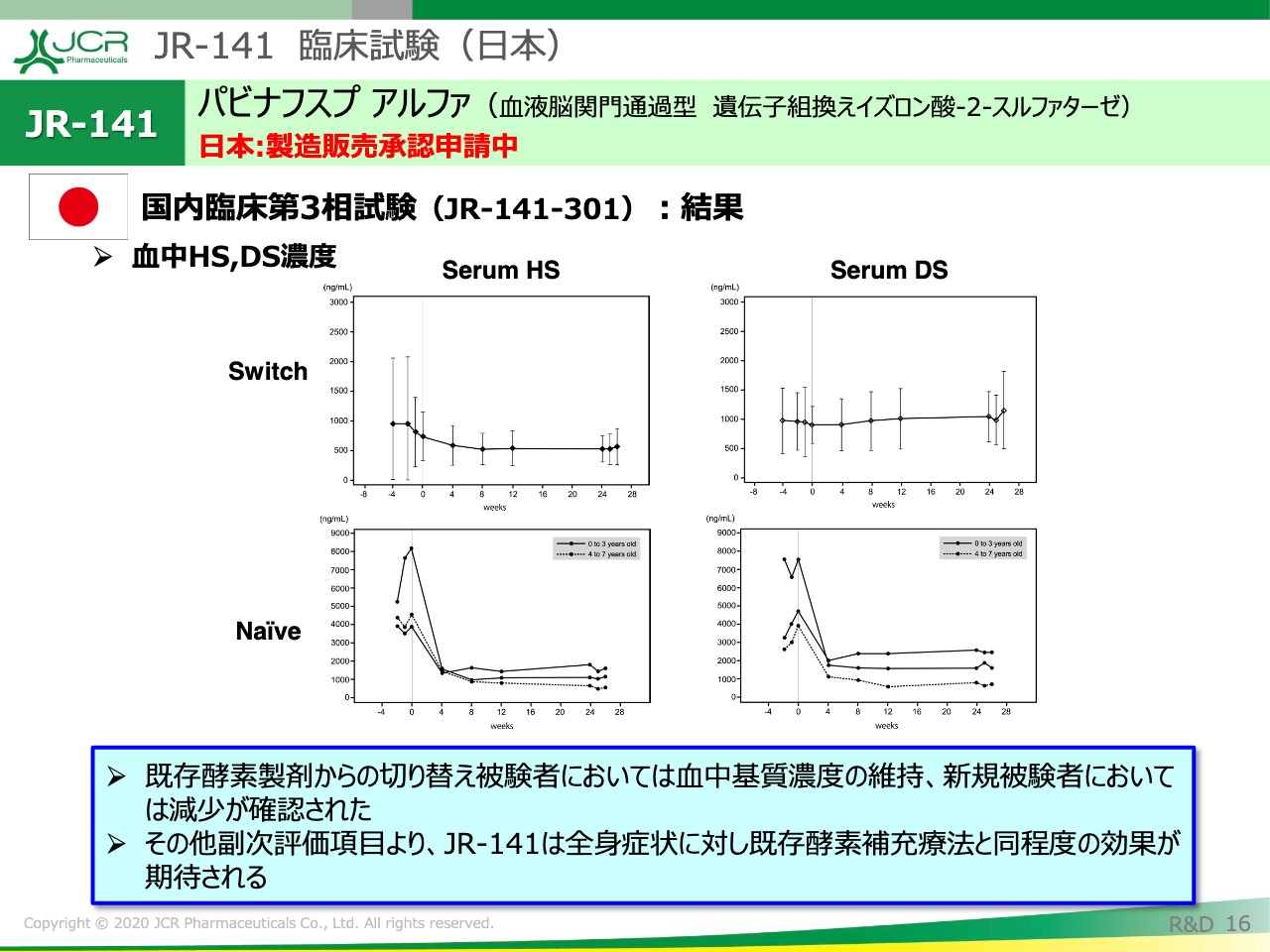
「JR-141」は酵素補充療法ですので、全身に対する評価が非常に重要です。こちらにお示ししたのは、血中のHS、DS濃度の推移です。上が切り替え患者、下が今回「JR-141」を初めて使われた患者の方々のデータです。
切り替え例におきましては、血中のHS、DSとも安定して推移していることがおわかりいただけるかと思います。新規例に関しては、期待どおり投与とともに急速に濃度が減少して、そのまま維持されています。
その他、副次評価項目の検討を行っていますので、「JR-141」は全身症状に対しては既存酵素補充療法と同程度の効果が期待されると考えています。
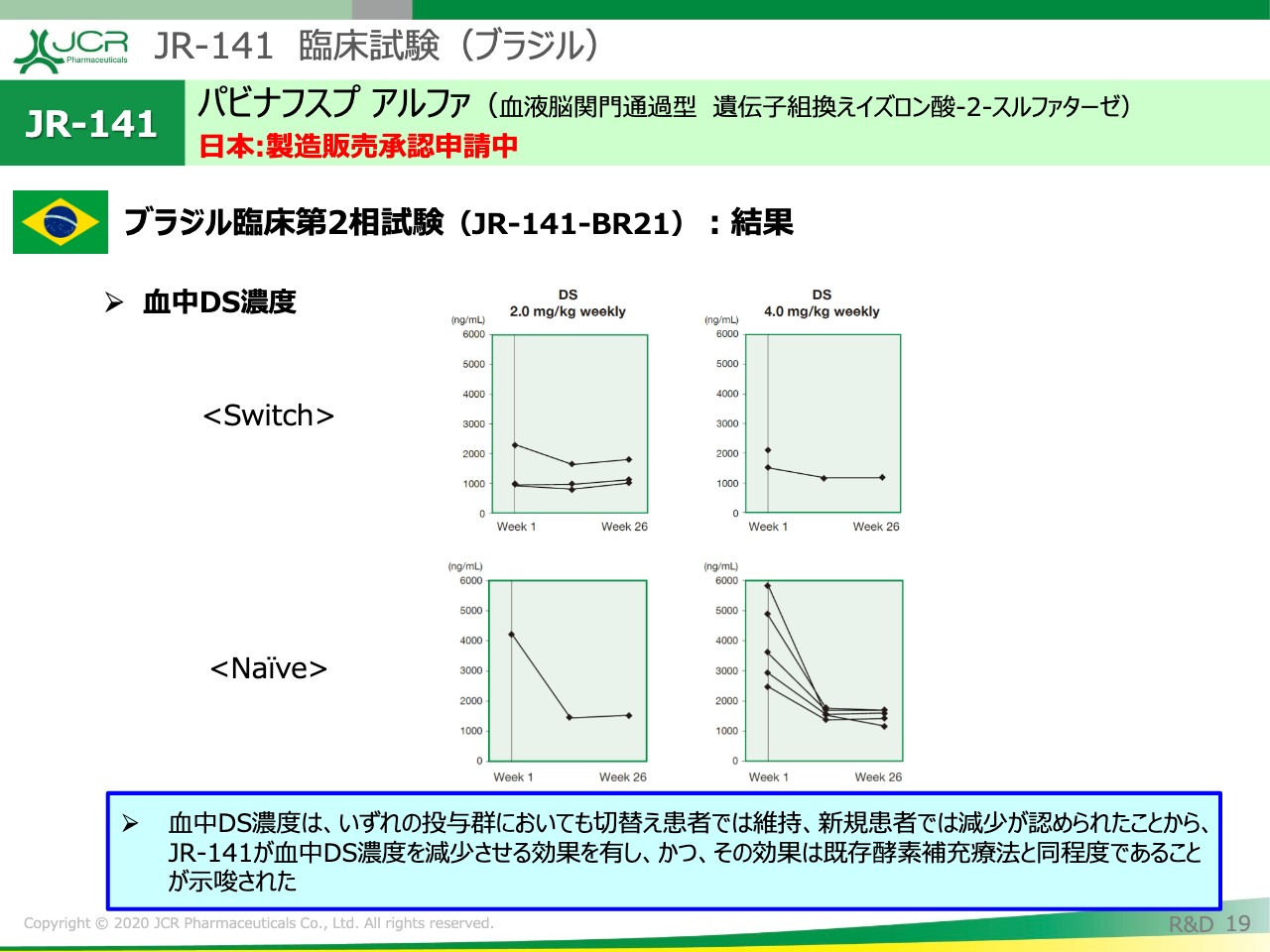
JR-141 臨床試験(ブラジル)①
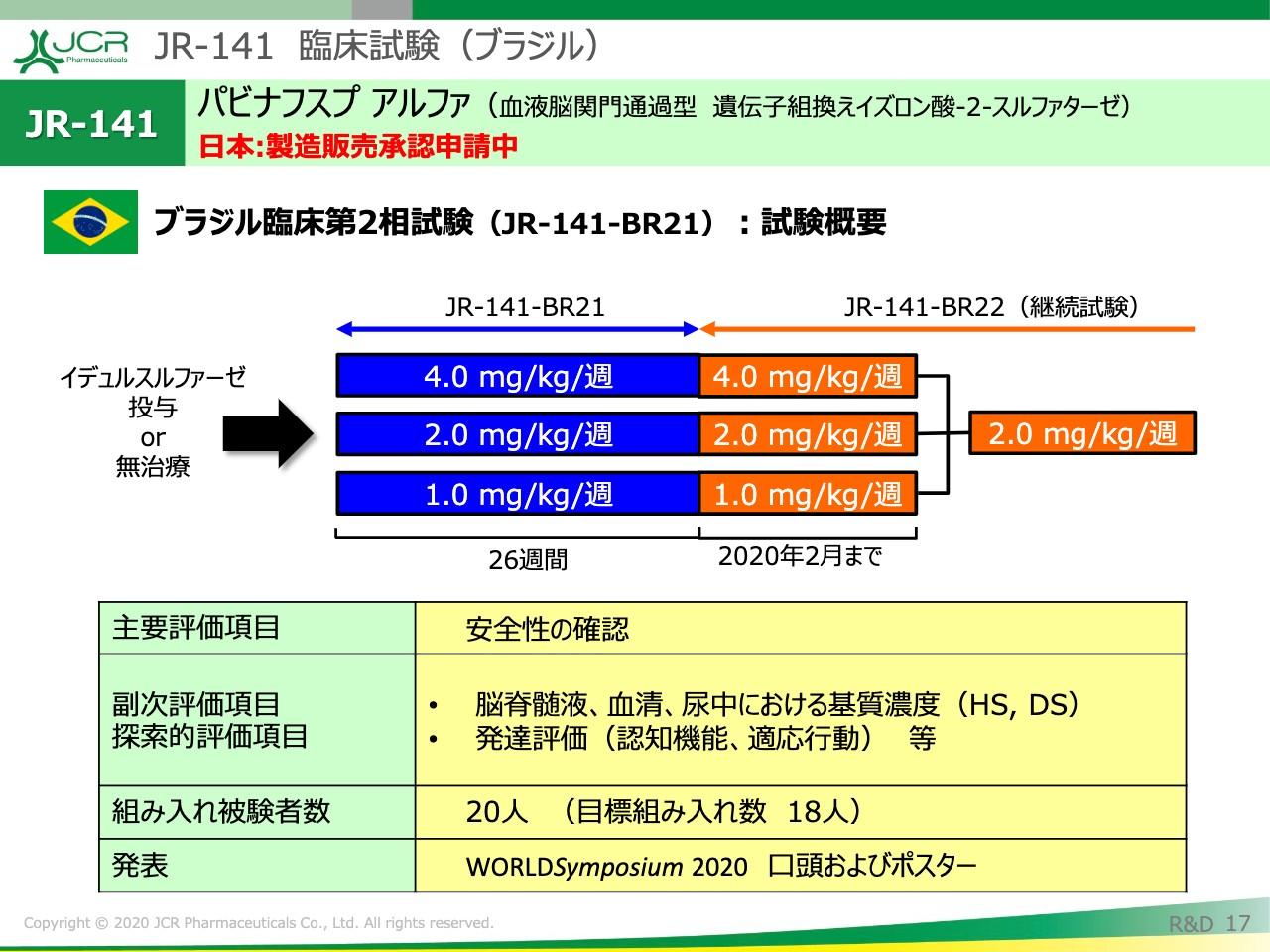
ここからは、ブラジルの試験結果に移りたいと思います。
ブラジルの試験の特徴は、1.0ミリグラム、2.0ミリグラム、4.0ミリグラムという3容量の検討が行われたことになります。この試験でも、脳脊髄液・血中・尿中のバイオマーカーの評価とか、発達年齢の評価を行っています。
JR-141 臨床試験(ブラジル)②
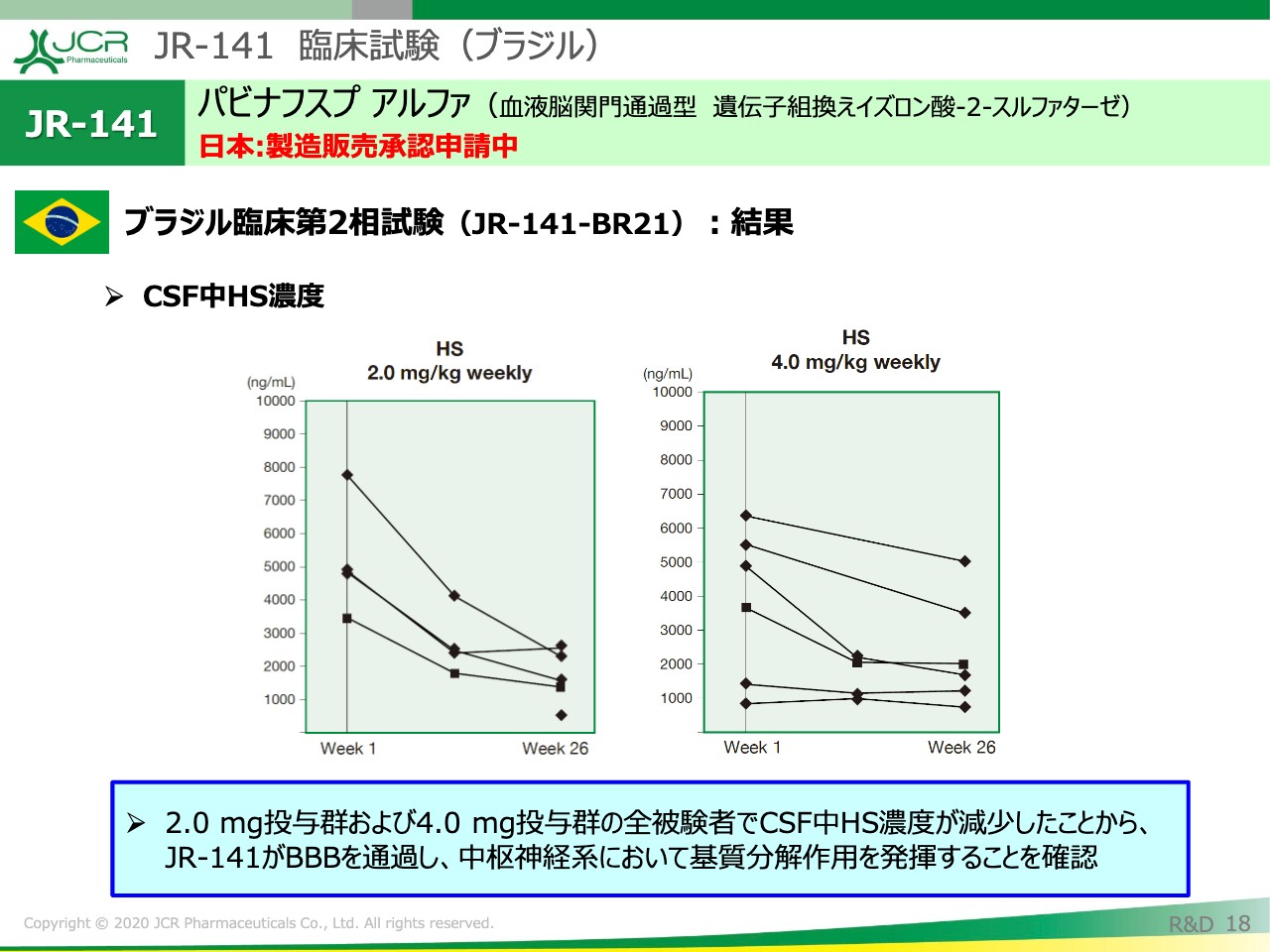
先ほど、日本の結果でもお示ししたとおり、ブラジルでも同様の結果が得られています。
まず、CSF中のHS濃度に関しては、2.0ミリグラム、4.0ミリグラムいずれも、全例においてCSF中のHS濃度が減少いたしました。
JR-141 臨床試験(ブラジル)③
こちらは血中のDS濃度を示しています。デルマタン硫酸は、全身症状に非常によく関連していることが知られていますので、このマーカーを見ていくことは非常に重要です。日本の結果と同様に、切り替え例では維持、新規例では減少が確認されました。
JR-141 臨床試験
おそらく、このスライドが非常に重要なところになるかと思います。日本の試験・ブラジルの試験ともに、被験者の変化に関する情報を治験責任医師から収集いたしまして、このようにまとめています。
ご覧いただけますように、言語面・表情面・運動面でさまざまな改善が認められています。特にご注目いただきたいのは言語面で、日本では語彙が増えた、理解力が増した、口頭の指示が理解できるようになった、またブラジルでは、文章で話そうとするようになったといった報告がございます。
ただ、この報告といいますのは、主観的なものです。今後、臨床試験で有効性を述べていく上では、このデータに加えて客観的な指標での裏付けが必要になります。
そこで、我々は現在、他で実施したBayley-ⅢスコアやVinelandスコアといったところと、行動学的変化の改善を評価いたしました。その結果、Vinelandのサブドメインになりますが、言語面での改善や、コミュニケーション面での改善が、スコアの改善として確認することができましたので、こうした行動学的改善が客観的指標によって裏付けられたと考えています。
JR-141 国内製造販売承認申請に関するまとめ
ここまでご報告を申し上げた臨床試験の内容をまとめています。これまでの試験において、「JR-141」投与に関連する重篤な有害事象は認められませんでした。また、中枢神経症状や兆候に対する有効性は確認できたものと考えています。本剤は静脈内投与ですので、既存の酵素製剤と同様に治療への導入が容易で、継続した治療が可能です。
非臨床試験から一貫してお示ししたとおり、バイオマーカー……疾患モデルにおける脳内のHS濃度と相関するCSF内でのHS濃度の減少が認められているということで、ヒトにおける脳内基質濃度減少の代替指標であるHSの有用性は、この試験を通じて示されたと考えています。
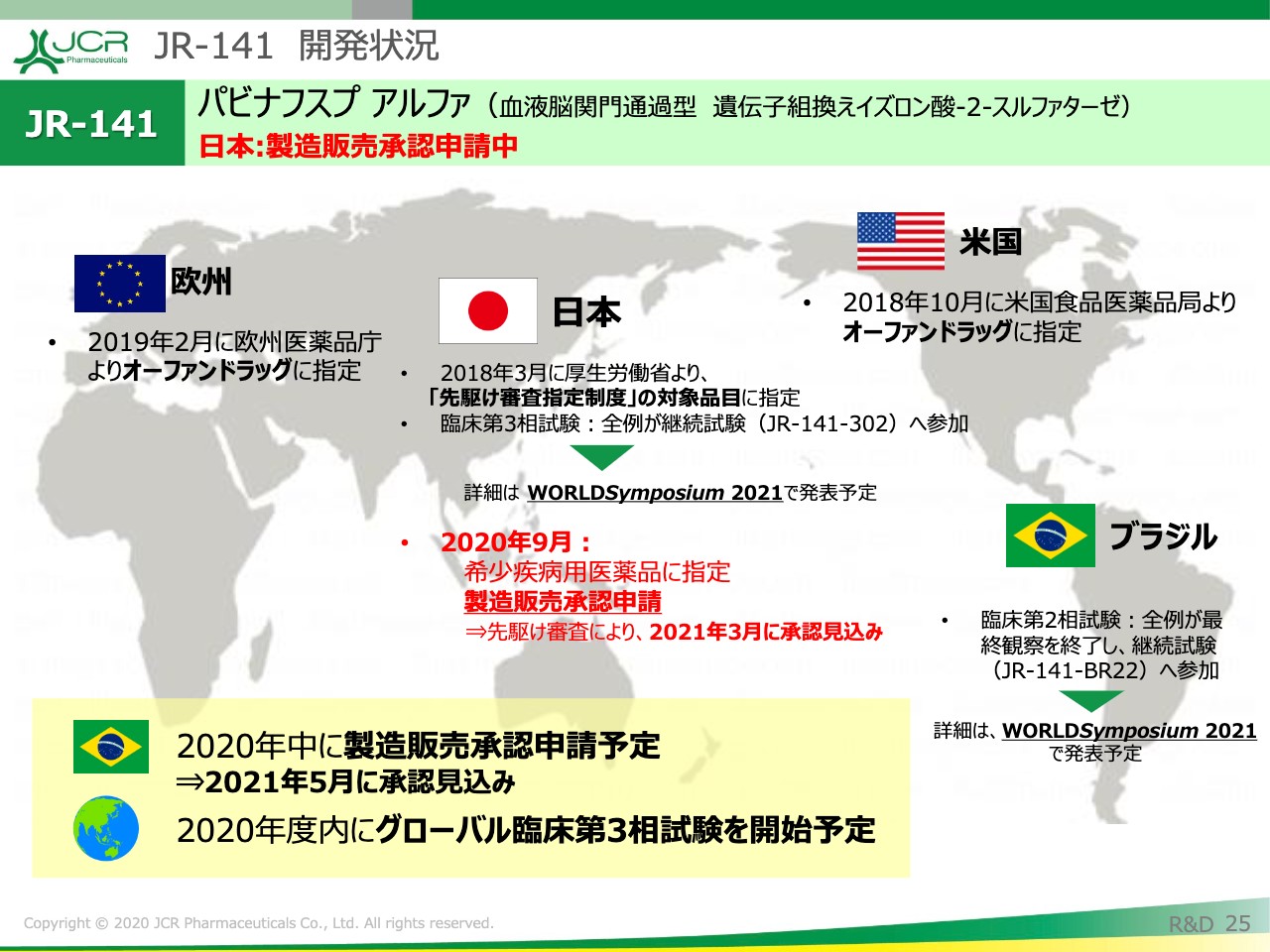
本剤は9月の段階で、製造販売承認申請を行いました。先駆け指定も受けていますので、期待どおりであれば、来年3月には承認が得られる見込みと考えています。これは、世界でも初めてのことではないかと思います。
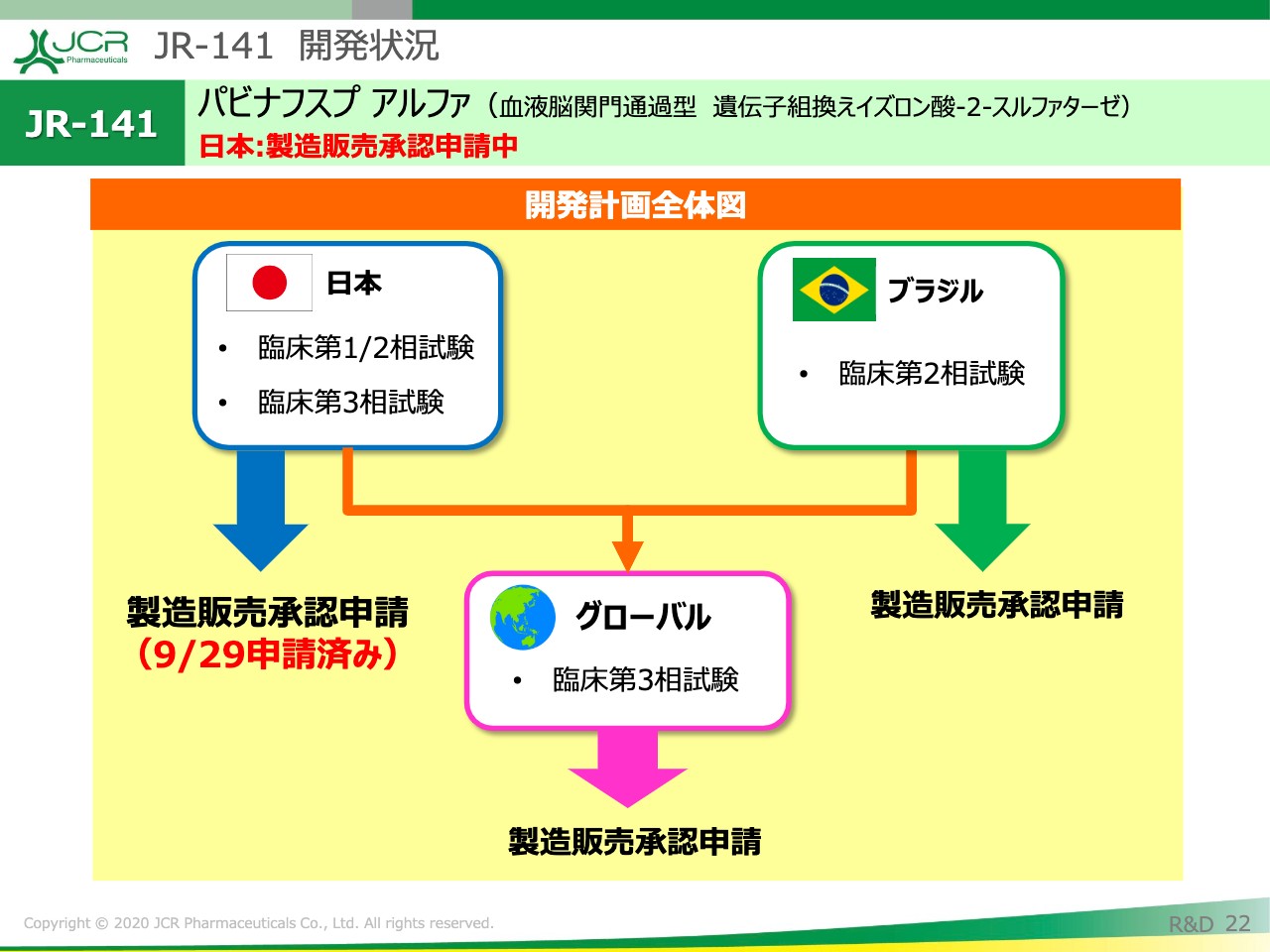
JR-141 開発状況②
それでは、ここから開発状況の全体像についてご説明申し上げます。
日本については、先ほどご説明を申し上げました。ブラジルにつきましても、本年中の製造販売承認申請を予定しています。それと並行して、グローバルでの臨床第3相試験の実施を計画しています。
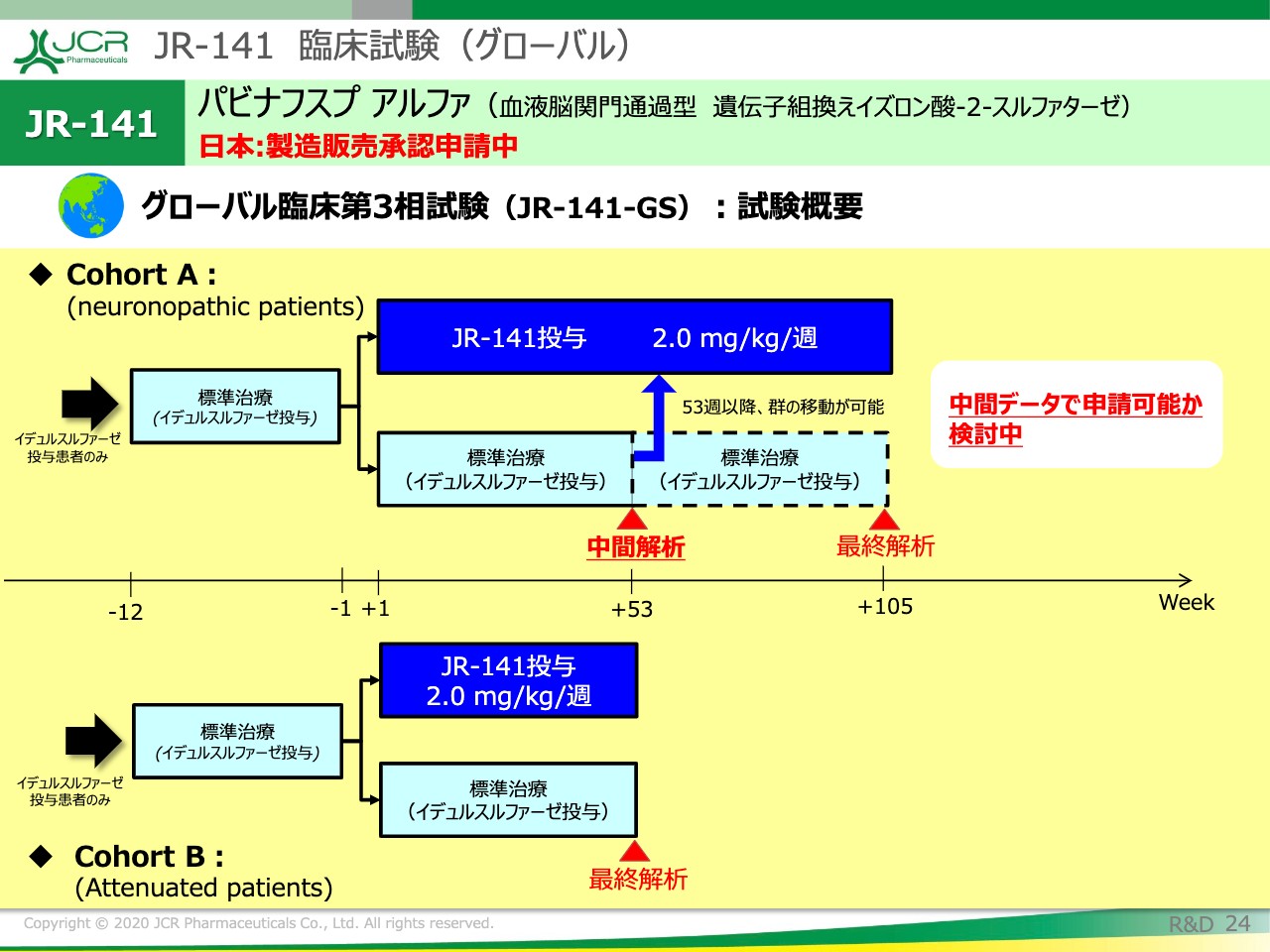
JR-141 臨床試験(グローバル)①
このスライドから、現在計画中のグローバル臨床第3相試験についてご説明を申し上げます。
実施予定国は、米国、ブラジル、そして欧州の3ヶ国です。試験の目的は、中枢神経症状および全身症状に対する有効性を示すことです。
試験の特徴としては、まず2つの患者群を設定したということがございます。また、標準治療薬対照並行群間比較試験であるところも特徴かと思います。この試験につきましては、約50名の患者の方々のリクルートを予定しています。
主要評価項目は、CSF中のHSに加えまして、中枢神経症状や全身症状といったところを合わせて評価する予定としています。
JR-141 臨床試験(グローバル)②
こちらに試験概要をお示ししています。
3歳から6歳の重症型の被験者をリクルートいたします。この疾患は、緩やかに中枢神経症状の悪化が進行する特性を持っていますので、今回、Cohort Aに関しては、2年間の評価期間を設定いたしました。
一方で、中枢神経症状に対して効果が期待できないとされている標準治療を2年間続けることに関しては、多くの先生方から倫理的な懸念ということでご意見をいただいています。そういったところを解決するために、今回の試験では52週以降、中間以降は、ある一定の基準を満たした場合には、「JR-141」の投与群に切り替えられる、群を跨いで切り替えられる設定をしています。Cohort Bは、1年間の解析になっています。
ですので、ご覧いただけますように、Cohort Bでの1年間の結果、またCohort Aでの中間解析の結果をもちまして、全身症状ならびに中枢神経症状に対する有効性が期待できるとされた場合には、中間データでの申請を検討したいと考えています。
JR-141 開発状況③
先ほど、日本における申請の状況についてご説明を申し上げましたが、ブラジルでは2020年中に製造販売承認申請を予定しています。その場合、予想どおりであれば、2021年5月には承認が得られる見込みです。
以上、「JR-141」のご説明を申し上げました。
JR-171 開発状況
そこに引き続く開発品目として、現在「JR-171」の開発を行っています。「JR-171」はムコ多糖症Ⅰ型で、アンメットメディカルニーズとしては、やはり中枢神経症状に対する有効な治療薬がないところがございます。すでに2020年7月には日本において、10月にはブラジルにおいて、治験計画届が受理されていますので、今後リクルートを進捗していきたいと考えています。
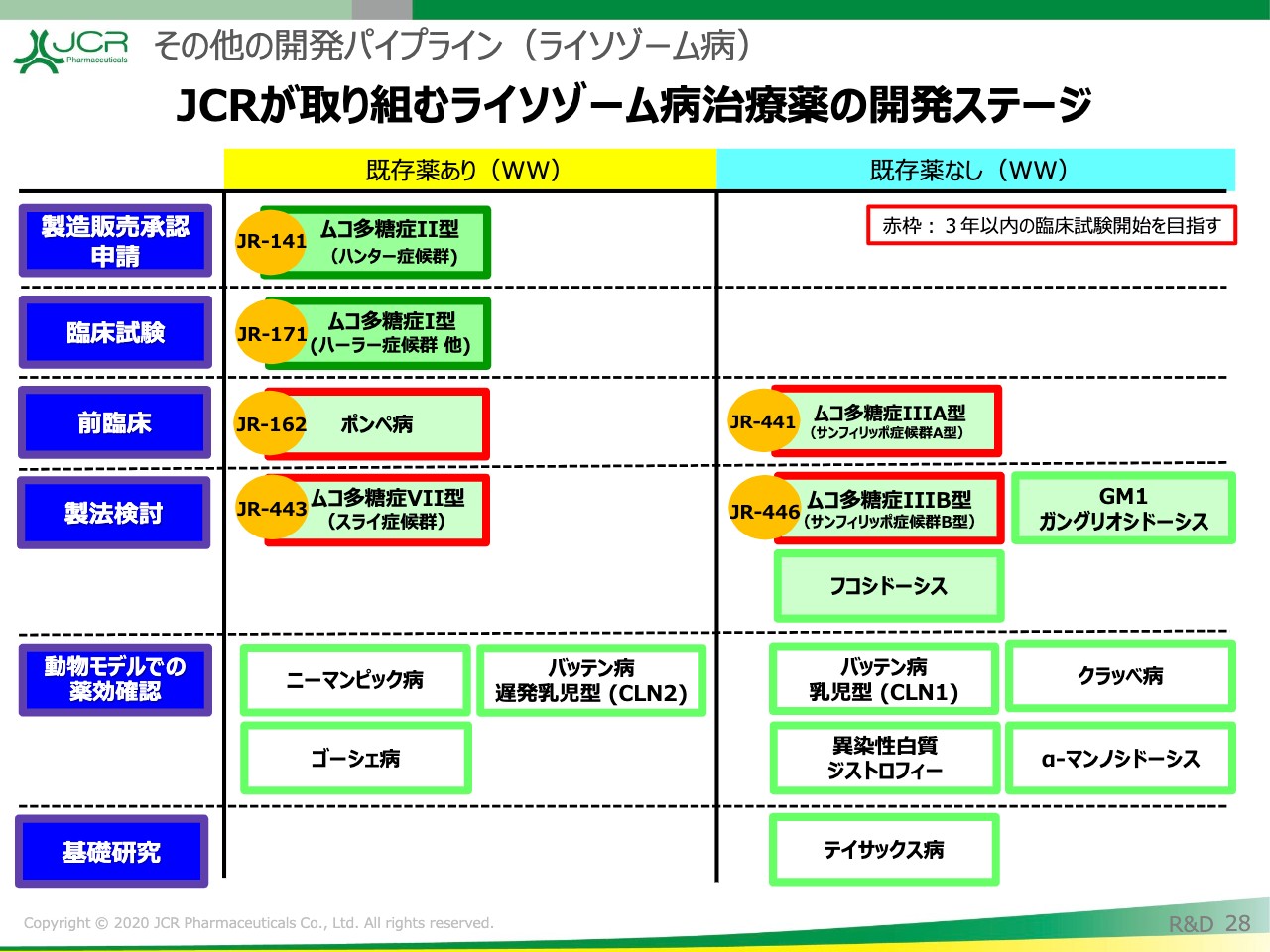
その他の開発パイプライン(ライソゾーム病)①
JCRが取り組むライソゾーム病治療薬の開発ステージです。
「JR-171」に続いて、右側に記載していますが、「JR-441」(ムコ多糖症ⅢA型)の開発を行います。また、「JR-162」(ポンぺ病)、「JR-443」(ムコ多糖症Ⅶ型)、「JR-446」(ムコ多糖症ⅢB型)につきましても、3年以内の治験実施を目指します。
その他の開発パイプライン(ライソゾーム病)②
こちらにタイムラインをお示ししています。先ほど申しましたとおり、「JR-441」に関しては2022年の試験開始を目指しています。以上が、ライソゾーム病治療薬の開発進捗ですが、そのほか成長ホルモン領域についても治験が進捗しています。
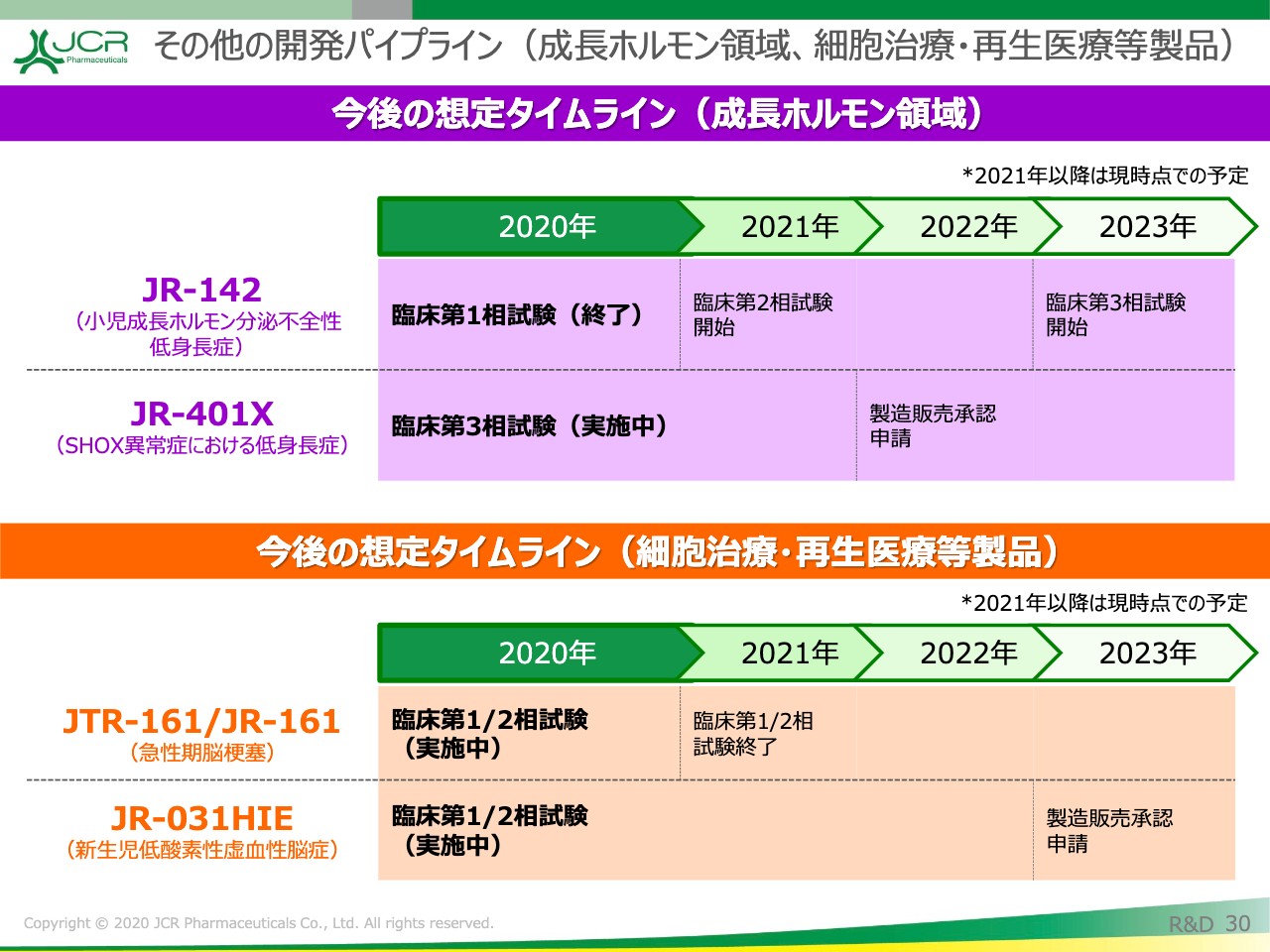
その他の開発パイプライン(成長ホルモン領域、細胞治療・再生医療等製品)
「JR-142」(長期作用型の成長ホルモン製剤)につきましては、2020年に臨床第1相試験を完了しています。現在、来年の第2相試験開始に向けて、当局ならびに先生方と協議を行っているところです。
「JR-401X」(SHOX異常症における低身長症)は、「グロウジェクト®」の適用拡大のプロジェクトです。こちらに関しても、本年6月に登録を完了いたしましたので、データが得られ次第、予定どおり申請を行いたいと思います。
再生医療等製品に関しては、「JTR-161」は帝人株式会社さんとの共同開発を行っています。また、自社で開発を行っている「JR-031HIE」(新生児低酸素性虚血性脳症)に関しては、現在リクルートの最終段階まで順調に推移しています。
以上、ライソゾーム病疾患、タンパク質製剤、再生医療等製品に関して、プロジェクトの進捗についてご報告を申し上げました。ありがとうございました。