2020年7月31日に行なわれた、第一三共株式会社2021年3月期第1四半期決算説明会の内容を書き起こしでお伝えします。
スピーカー:第一三共株式会社 代表取締役副社長 兼 CFO 齋寿明 氏\n第一三共株式会社 常務執行役員 研究開発本部長 高崎渉 氏
COVID-19感染症対策への取り組み アップデート
齋寿明氏:本日はご多忙のところ、第一三共の決算カンファレンスコールにご参加いただき、ありがとうございます。それでは、本日(2020年7月31日)13時に発表いたしました2020年度第1四半期決算につきまして、資料に基づき説明させていただきます。
本日は、新型コロナウイルス(COVID-19)感染症対策への取り組み、「DS-1062」の戦略的提携、2020年度第1四半期の連結決算、2020年度業績予想、ビジネスアップデートの順番でお話しします。その後、研究開発本部長の高崎から、研究開発アップデートについてお話しします。
スライド3ページをご覧ください。こちらのスライドでは、COVID-19感染症対策への取り組みをお示ししております。
まず、ワクチンの製造・供給です。アストラゼネカがオックスフォード大学と開発中のワクチンの国内供給について、6月に当社との協議を開始しました。アストラゼネカから原液供給を受け、当社子会社の第一三共バイオテックが受託製造を行う予定です。
次に、ワクチン・治療薬の開発です。AMEDが実施中の遺伝子(mRNA)ワクチンの開発に向けた取り組みに参画しています。動物試験で抗体価の上昇を確認したことから、本ワクチンの開発を当社の最優先プロジェクトの1つに位置付け、2021年3月を目処に、臨床試験を開始することを目指しています。
また6月には、COVID-19治療薬としてナファモスタット吸入製剤を、東京大学、理化学研究所、日医工と共同開発することを決定しました。当社はイナビルの開発経験を活かして、製剤研究、非臨床研究、臨床開発を担当する予定です。すでに処方検討と非臨床試験を開始しており、当局と協議した上で、2021年3月までの臨床試験への移行を目指します。
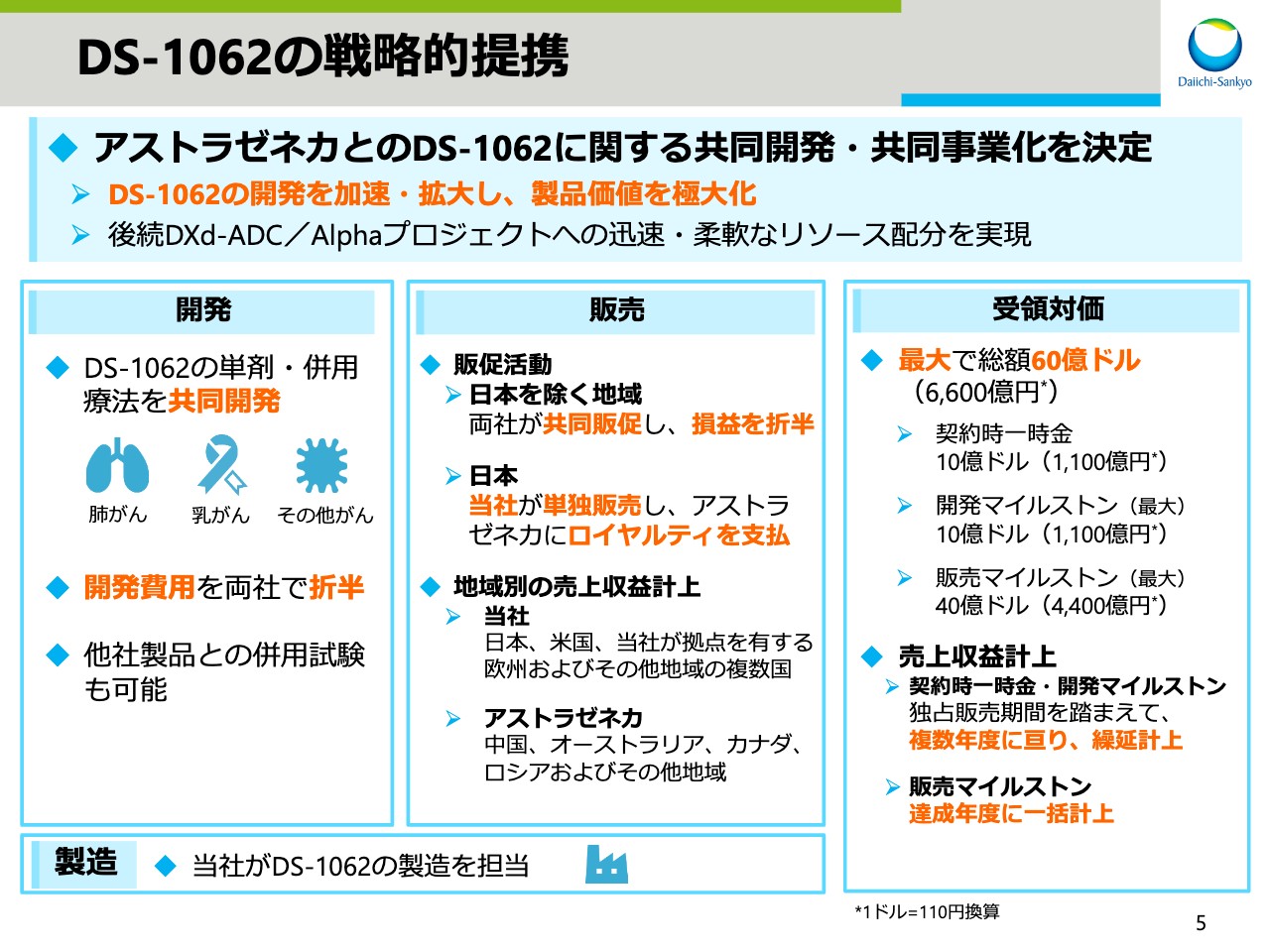
DS-1062の戦略的提携
次に、「DS-1062」の戦略提携についてお話しします。今週月曜日(2020年7月27日)にご案内したとおり、当社は抗TROP2抗体薬物複合体「DS-1062」について、アストラゼネカと共同開発・共同事業化を行うことを決定いたしました。本日は詳細な説明は割愛させていただきますが、共同開発・共同事業化の枠組みは「エンハーツ」とほぼ同様です。
本戦略的提携により「DS-1062」の開発を加速・拡大し、製品価値を極大化させるとともに、製品ポテンシャルが向上している後続の「DXd-ADC」やAlphaプロジェクトのリソース面における需要増に迅速・柔軟に対応しながら、パイプライン価値と企業価値の最大化を目指していきます。
連結業績の概要
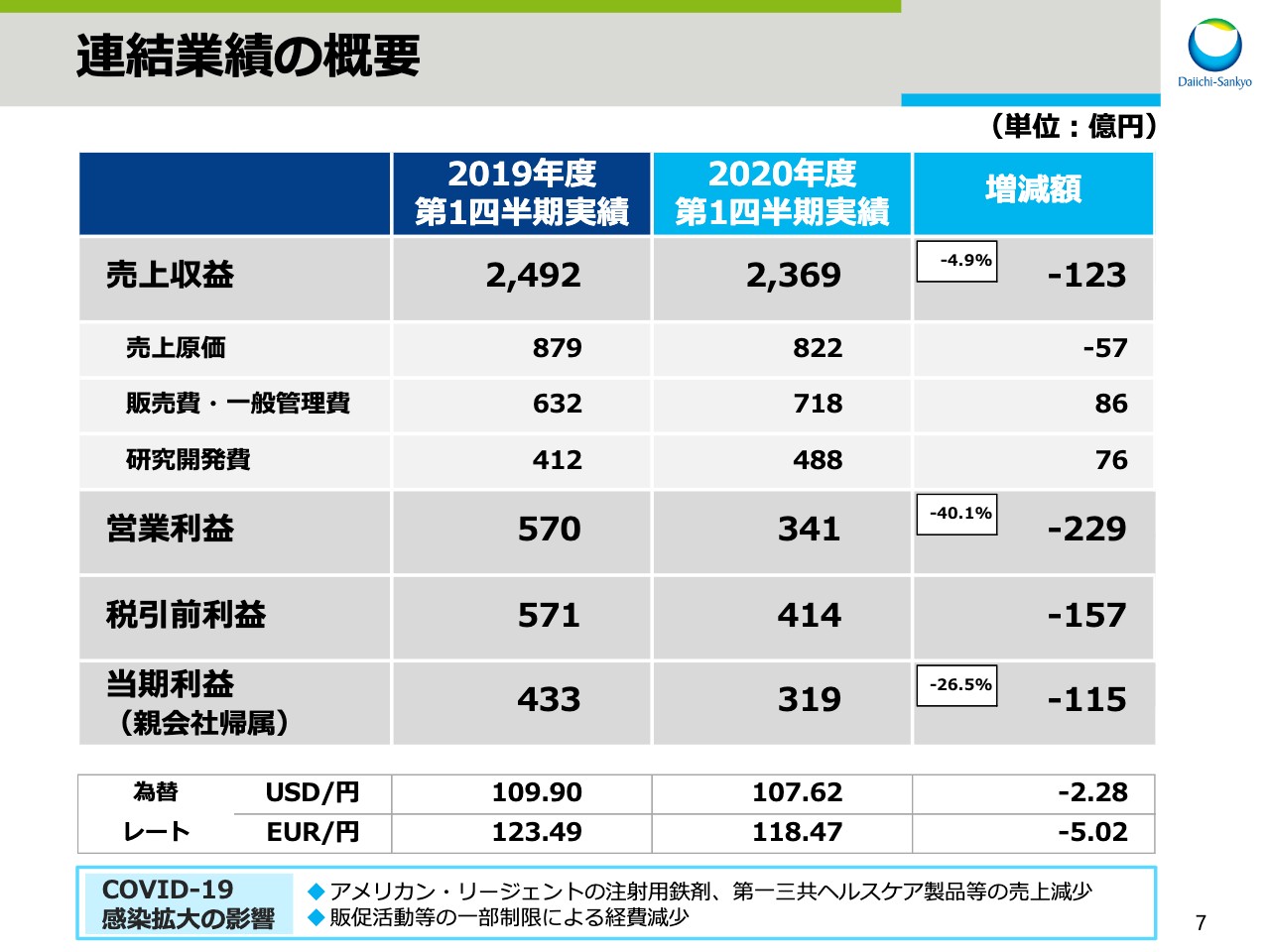
次に、2020年度第1四半期連結決算についてお話しします。まず、2020年度第1四半期決算の概要です。
連結売上収益は2,369億円と、前年同期比で123億円、4.9パーセントの減収となりました。売上原価は前年同期比で57億円減、販売費・一般管理費は86億円増、研究開発費は76億円増となりました。
この結果、営業利益は341億円と、前年同期比で229億円、40.1パーセントの減益。税引前利益は前年同期比で157億円減益の414億円でした。親会社帰属の当期利益は319億円と、前年同期比で115億円、26.5パーセントの減益となりました。
為替レートの実績については、1ドルは107円62銭となり、前期よりも2円28銭の円高、1ユーロは118円47銭となり、前期よりも5円2銭の円高となりました。
なお、COVID-19の感染拡大による影響について、売上収益はアメリカン・リージェントの注射用鉄剤や第一三共ヘルスケア製品等、一部製品の売上減少の影響がありました。
また、経費につきましては、販売促進活動等が一部制限されていたことにより、減少影響がありました。これらの結果、営業利益への影響は軽微でした。
売上収益増減
ここからは、前年同期比での増減要因について説明いたします。売上収益は、前年同期比で123億円の減収となりました。その内訳を主要事業ユニット別にご説明いたします。
まず、国内医薬です。ワクチンヘルスケアを含む日本事業では、昨年(2019年)4月に発売した疼痛治療剤「タリージェ」の売上が拡大したものの、抗潰瘍剤「ネキシウム」、直接経口抗凝固剤「リクシアナ」、アルツハイマー型認知症治療剤「メマリー」に加え、ワクチン事業と第一三共ヘルスケア製品の売上が減少したため、日本事業全体では106億円の減収となりました。
次に海外事業についてですが、ここでは為替変動の影響を除外したかたちで記載しております。米国の第一三共Inc.は、今年1月に上市した抗悪性腫瘍剤「エンハーツ」の寄与により、40億円の増収となりました。一方、米国のアメリカン・リージェントは、鉄欠乏性貧血治療剤「インジェクター」と「ヴェノファー」に加え、GE注射剤の減収により、89億円の減収となりました。
第一三共ヨーロッパは、「リクシアナ」の売上拡大に加え、長期収載品の譲渡益を計上したことにより、68億円の増収となりました。
アジア、中南米地域を担当するASCA事業と「トラスツズマブ デルクステカン」の戦略的提携に関わる契約一時金および開発マイルストンの当期売上収益認識分は、それぞれ2億円の増収となりました。なお、為替による減収影響は全体で40億円でした。
営業利益増減
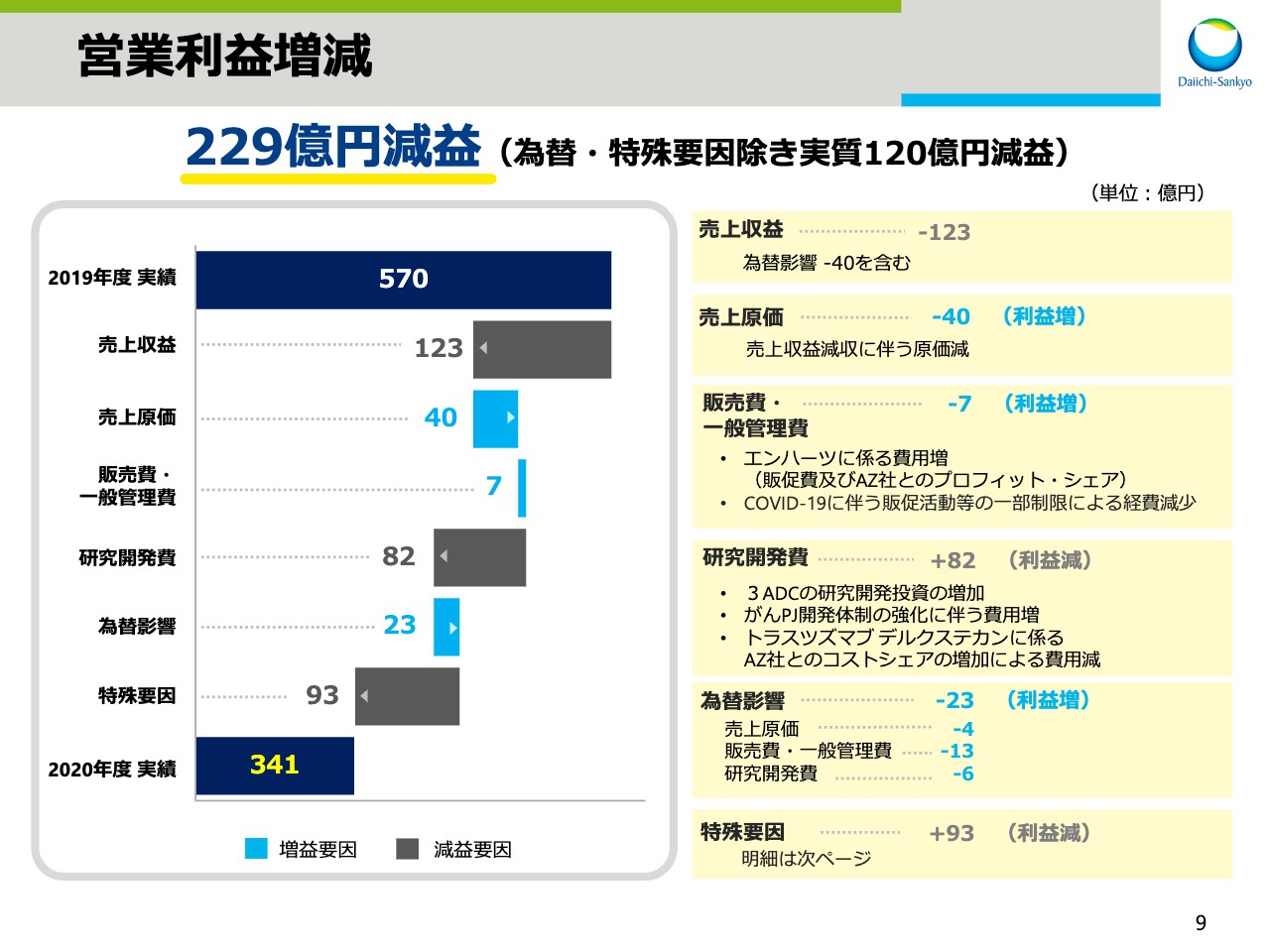
次に、スライド9ページをご覧ください。こちらは営業利益の増減要因をお示ししております。229億円の減益について、項目別に説明させていただきます。先ほどの説明のとおり、売上収益は為替影響による減収40億円を含めて、123億円の減収となりました。
次に、経費関連を為替影響・特殊要因を除いて説明いたします。売上原価は、売上収益の減少に伴い、40億円減となりました。販売費・一般管理費は、「エンハーツ」の販促費が増加した一方で、COVID-19の感染拡大に伴う販売促進活動等の一部制限による経費減少等により、7億円の減少となりました。
研究開発費は「トラスツズマブ デルクステカン」に係るアストラゼネカとのコストシェアの増加による費用減があったものの、3 ADCの研究開発投資の増加およびがんプロジェクトの開発体制強化に伴う費用増により、82億円増となりました。
為替影響による費用減は、合計で23億円でした。特殊要因では、前期と比較して93億円の費用の増加影響がありました。この要因内訳については後ほどご説明いたします。なお、為替と特殊要因による影響を除外すると、実質で120億円の減益でした。
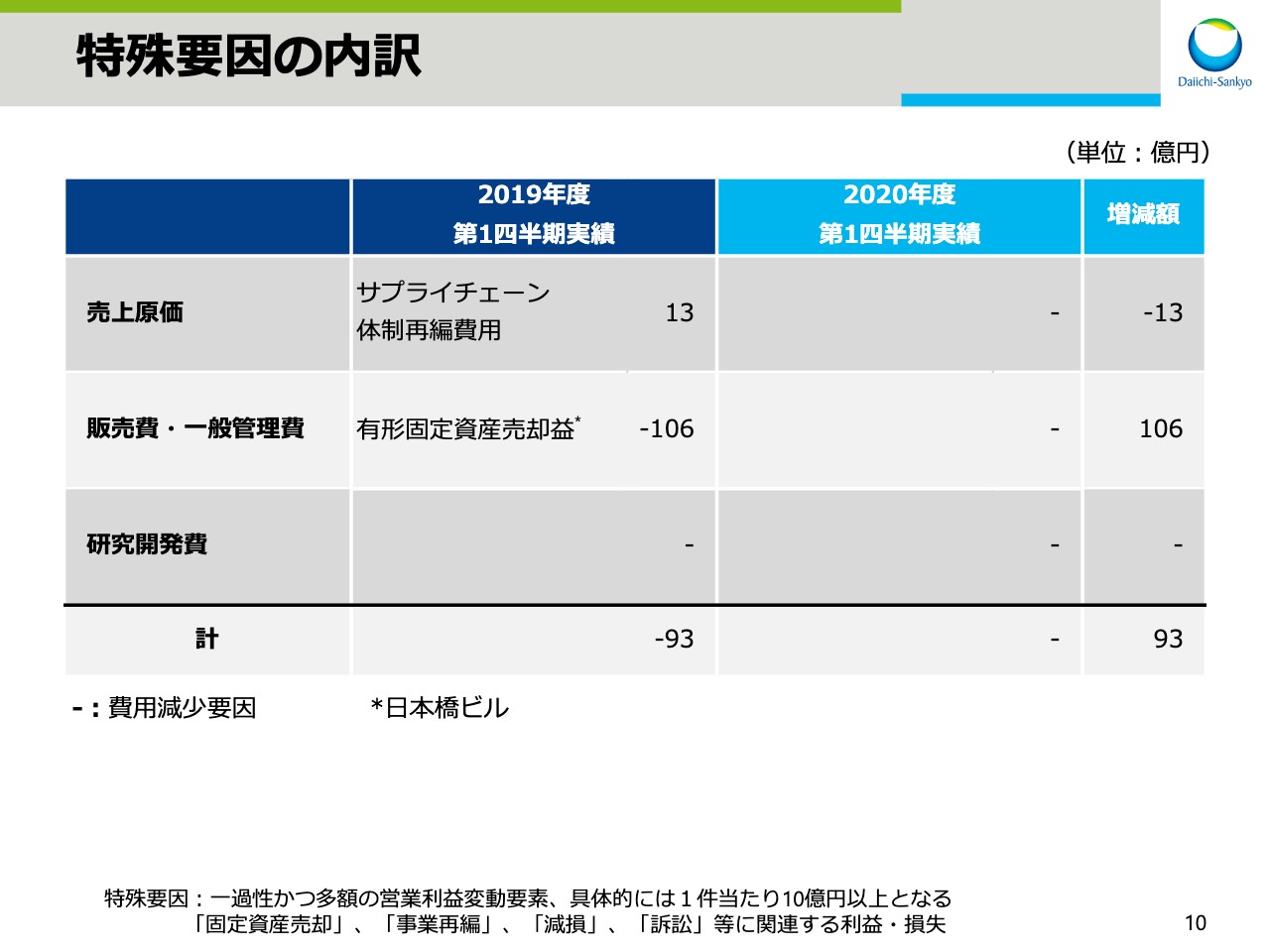
特殊要因の内訳
特殊要因の内訳です。前期はサプライチェーン体制の再編費用13億円を計上した一方で、有形固定資産売却益106億円を計上したことにより、合計で93億円の費用の減少影響がありました。今期はこの特殊要因がなかったため、前期に比べ93億円の費用の増加影響がありました。
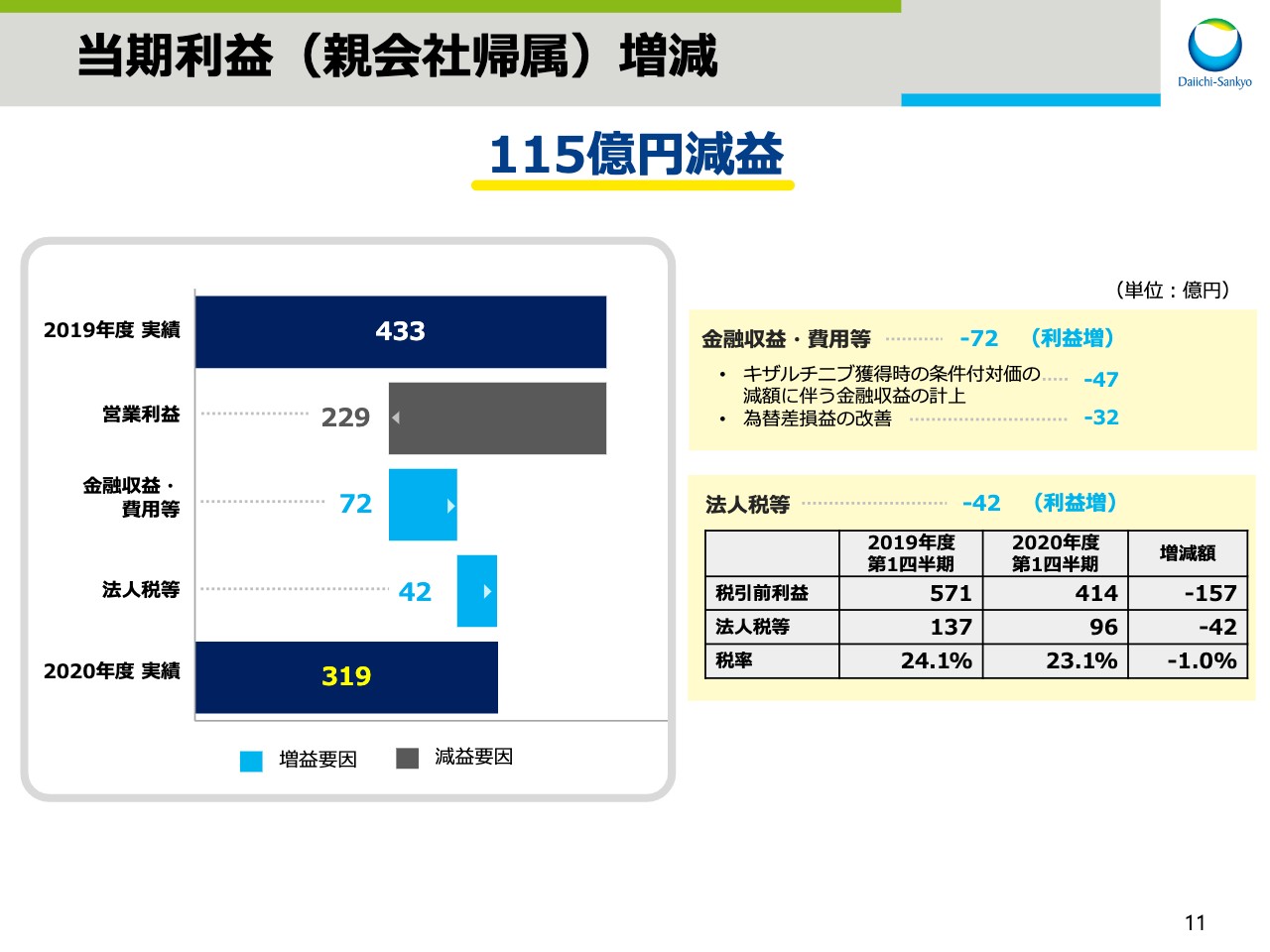
当期利益(親会社帰属)増減
次に、当期利益についてご説明いたします。営業利益は先ほどの説明のとおり、為替と特殊要因による影響も含め、229億円の減益となりました。金融収支・費用は「キザルチニブ」獲得時の条件付対価の減額に伴う金融収支を47億円計上したことに加え、為替差損益が32億円改善したことにより、前年同期に比べ72億円の増益影響がありました。
法人税等は、税引前利益の減少により、前年同期に比べ42億円減少しました。その結果、親会社帰属の当期利益は319億円、前年同期比で115億円の減益となりました。
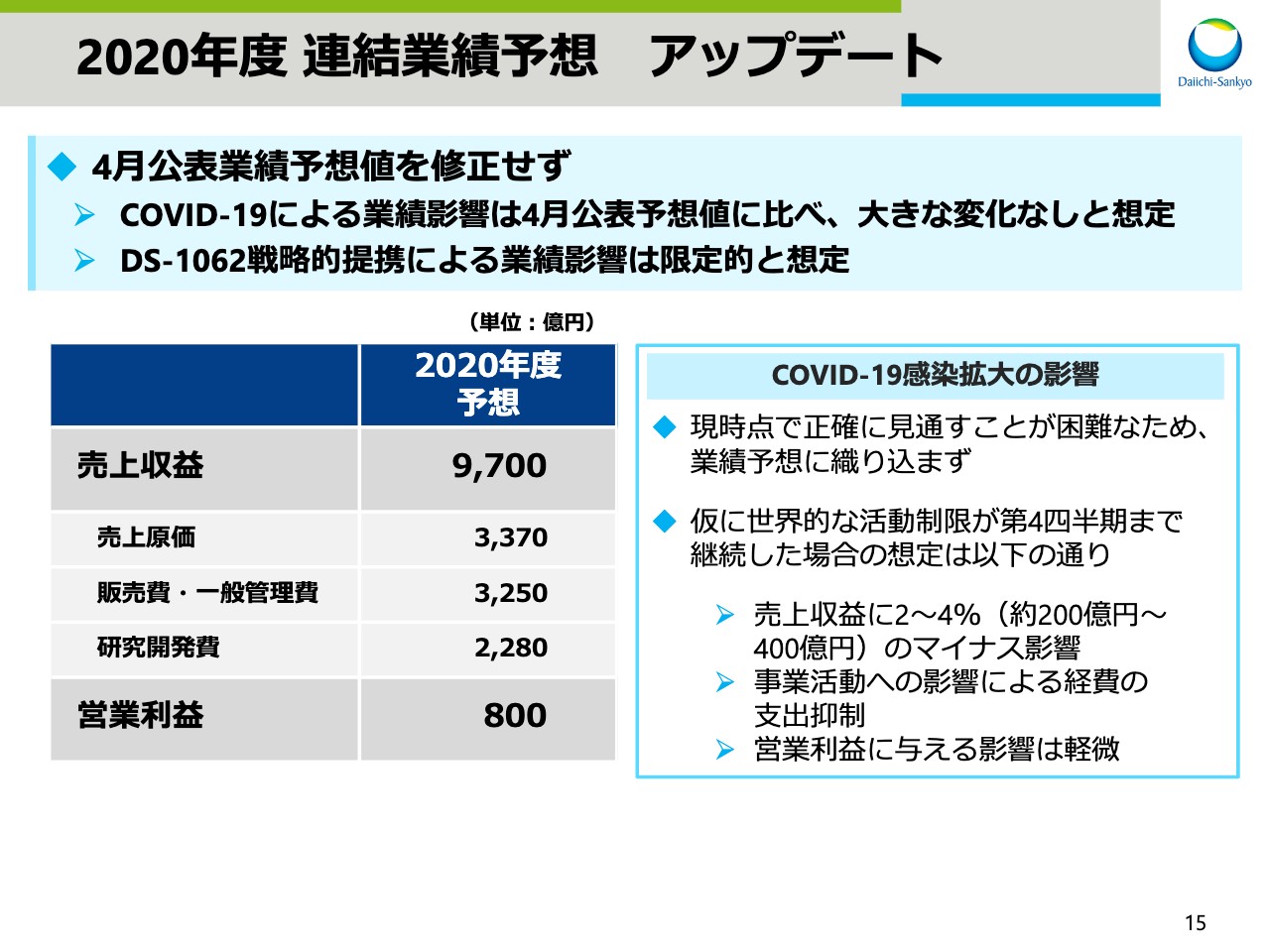
2020年度 連結業績予想 アップデート
次に、2020年度業績予想についてお話しします。2020年度の業績予想は、4月公表の予想値を修正せず、据え置くことといたします。COVID-19感染拡大の影響は、現時点で正確に見通すことが困難であるため、ここでお示しする業績予想には織り込んでいませんが、4月の公表予想値と比べ、大きな変化はないと想定しています。
具体的には、仮に世界的な活動制限が、第4四半期、今年度末まで続いた場合、売上収益に2~4パーセント、約200~400億円のマイナス影響が見込まれますが、同時に事業活動への影響による経費の支出抑制が見込まれるため、営業利益に与える影響は軽微と想定しております。
また、「DS-1062」の戦略提携に伴う契約一時金の売上収益計上と開発コストのシェアによる費用減などの影響はありますが、それらが通期連結業績に与える影響は限定的と想定しております。
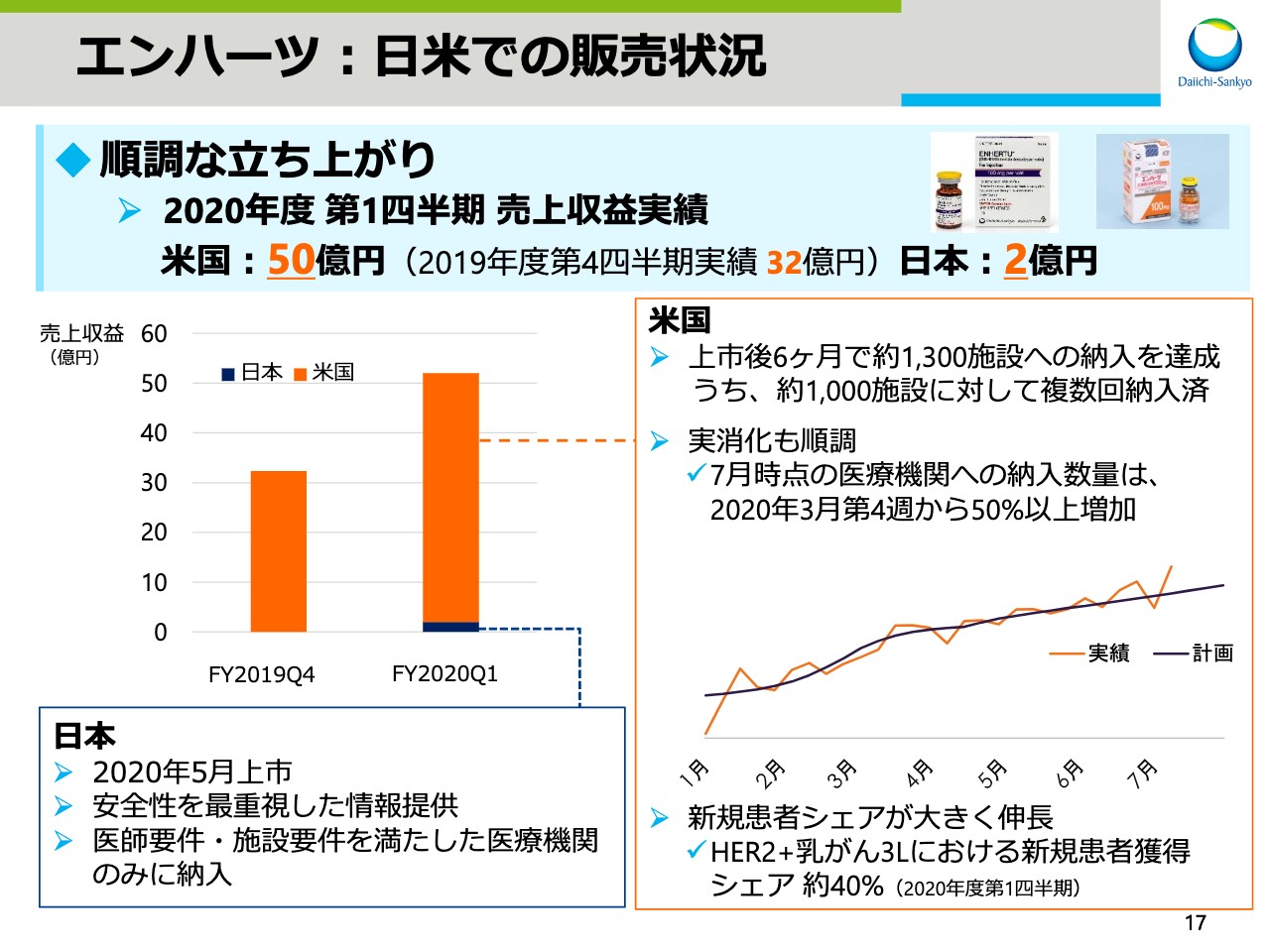
エンハーツ:日米での販売状況
次にビジネスアップデートについてお話しします。まず、「エンハーツ」の日米での販売状況についてです。
「エンハーツ」は順調な立ち上がりを示しており、2020年度第1四半期売上収益は、米国で50億円、日本で2億円でした。
米国では上市後6ヶ月で約1,300施設への納入を達成しました。そのうち約1,000施設に対しては複数回納入しております。医療機関への納入数量は、7月時点で昨年度末から50パーセント以上増加しており、実消化も順調に推移しております。
新型コロナウイルスによる受診抑制などの影響を受ける中で、上市前に作成した計画どおりに実績が推移していると判断しております。
また、HER2陽性乳がんのサードラインにおける新規患者の獲得シェアは約40パーセントであり、こちらについても順調に拡大しております。
日本では2020年5月に上市し、安全性を最重視した情報提供を行っております。医師要件、施設要件を満たした医療機関のみに納入するなど、安全性マネジメントを徹底しております。
続いて、研究開発アップデートです。研究開発本部長の高崎にバトンタッチします。
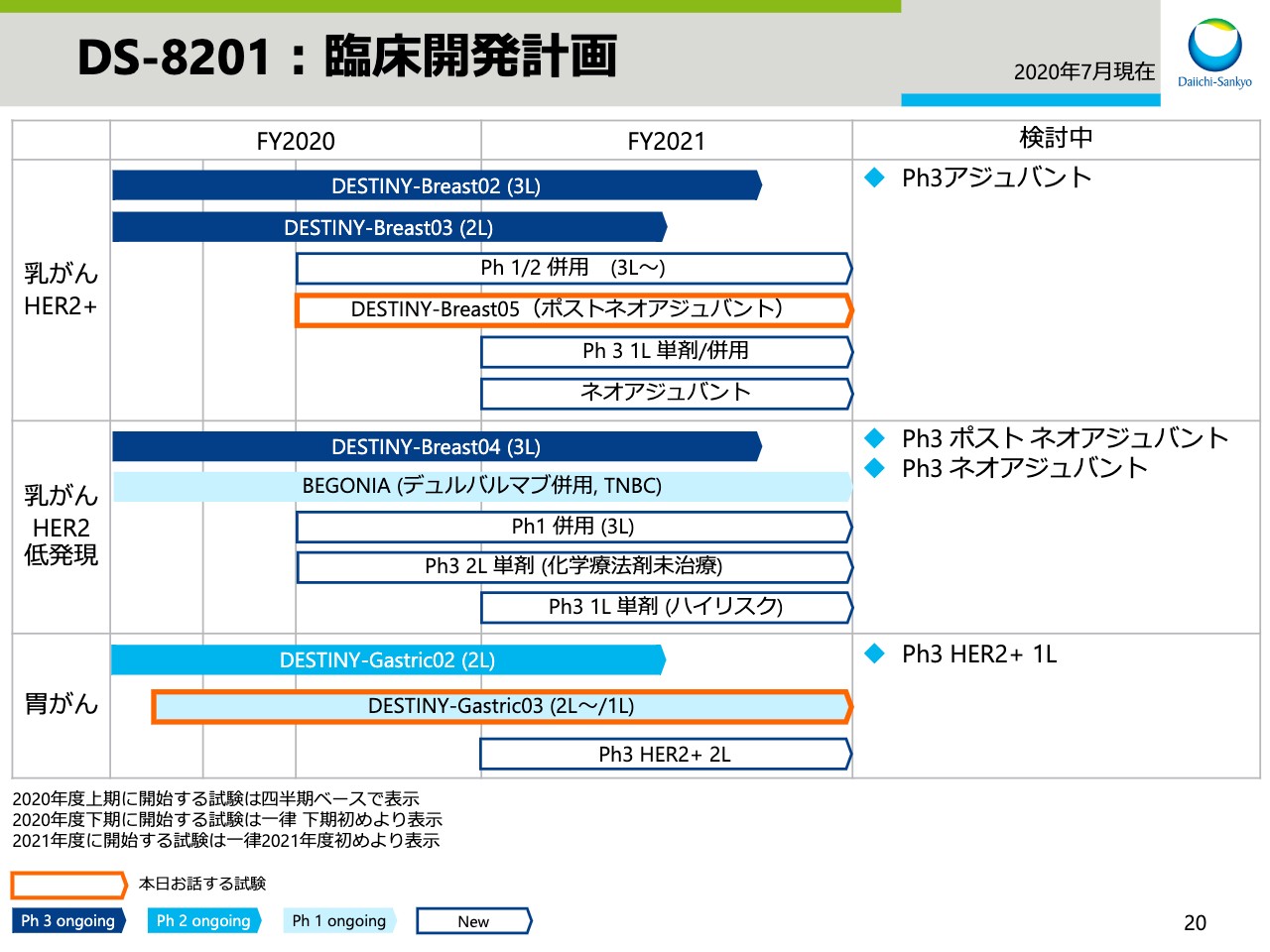
DS-8201:臨床開発計画①
高崎渉:高崎でございます。本日は、私より研究開発のアップデートについてお話しさせていただきます。
スライド21で「DS-8201」の開発計画をお示ししております。オレンジの枠でハイライトした試験について、本日はお話しさせていただきます。
DS-8201:臨床開発計画②
乳がんの新たな試験であるDESTINY-Breast05試験を、2020年度下期に開始予定です。本試験は、ネオアジュバント後に浸潤性残存病変を有するHER2陽性乳がんのうち、再発リスクが高い患者を対象としたT-DM1との直接比較試験です。
無浸潤疾患生存期間などを評価項目とした試験のため、試験期間はこれまでの試験と比較して長期となる予定です。
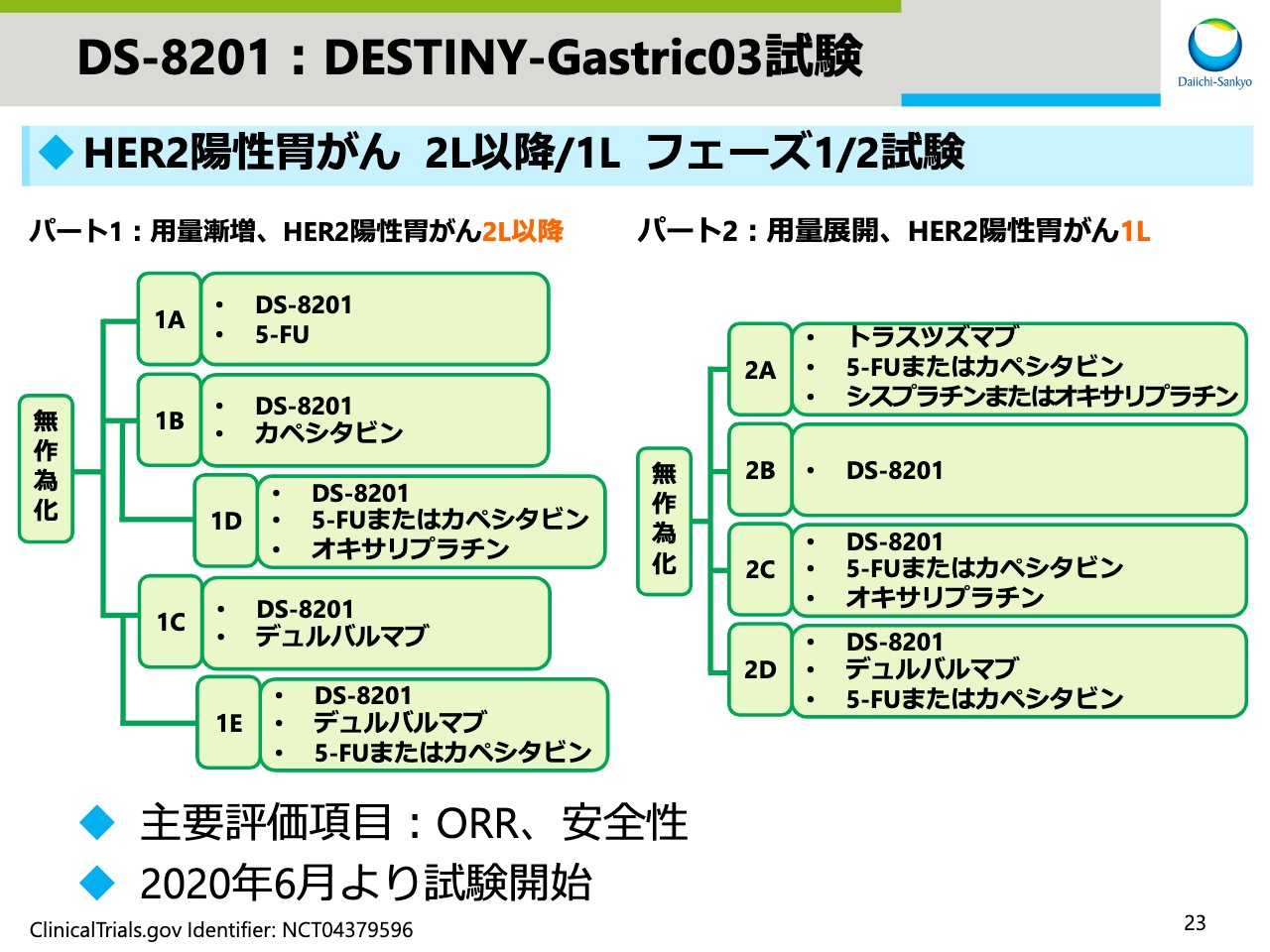
DS-8201:DESTINY-Gastric03試験
新たな試験であるDESTINY-Gastric03試験の概要です。本試験はHER2陽性胃がんの2L、1Lを対象としたフェーズ1/2試験です。
「DS-8201」単剤、アストラゼネカのIO「デュルバルマブ」との併用、その他化学療法剤との併用など、さまざまな組み合わせの有効性と安全性を確認し、この後に行うピボタル試験でのベストの薬剤の組み合わせ、用量を確認する試験です。本試験は本年6月より開始しております。
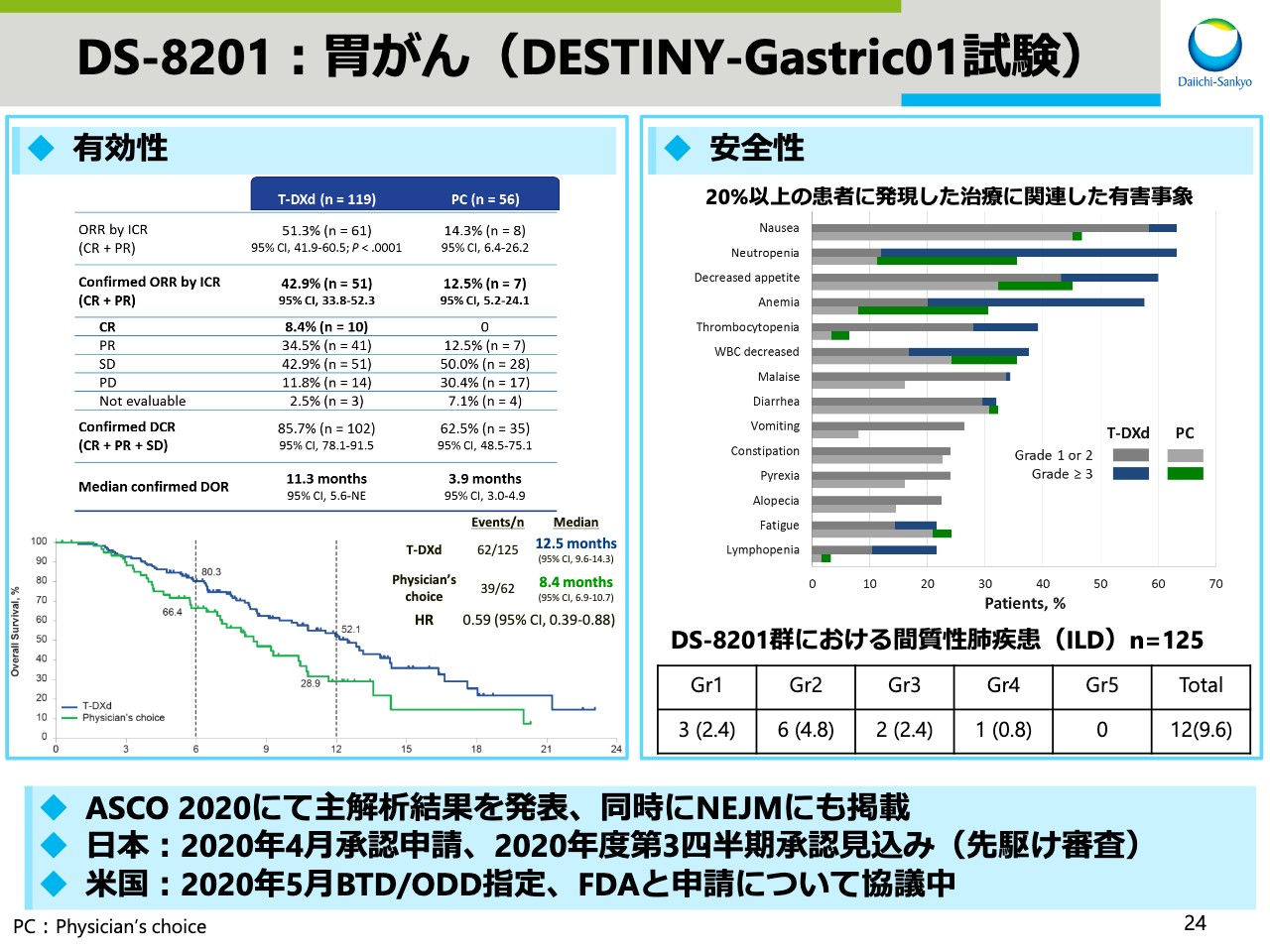
DS-8201:胃がん(DESTINY-Gastric01試験)
スライド24ページからは、ASCOで発表した「DS-8201」と「DS-1062」の再掲になります。
胃がんについては、本試験の主要評価項目である客観的奏効率(ORR)および副次評価項目である全生存期間(OS)において、「DS-8201」投与群は、治験医師選択薬投与群に対し、統計学的に有意、かつ臨床的意義の高い改善を示し、日本では4月末に承認申請しています。
米国FDAからは、5月にブレークスルーセラピーおよびオーファンドラッグ指定を受けました。今後の米国での申請に関しては、FDAとただいま協議中であります。
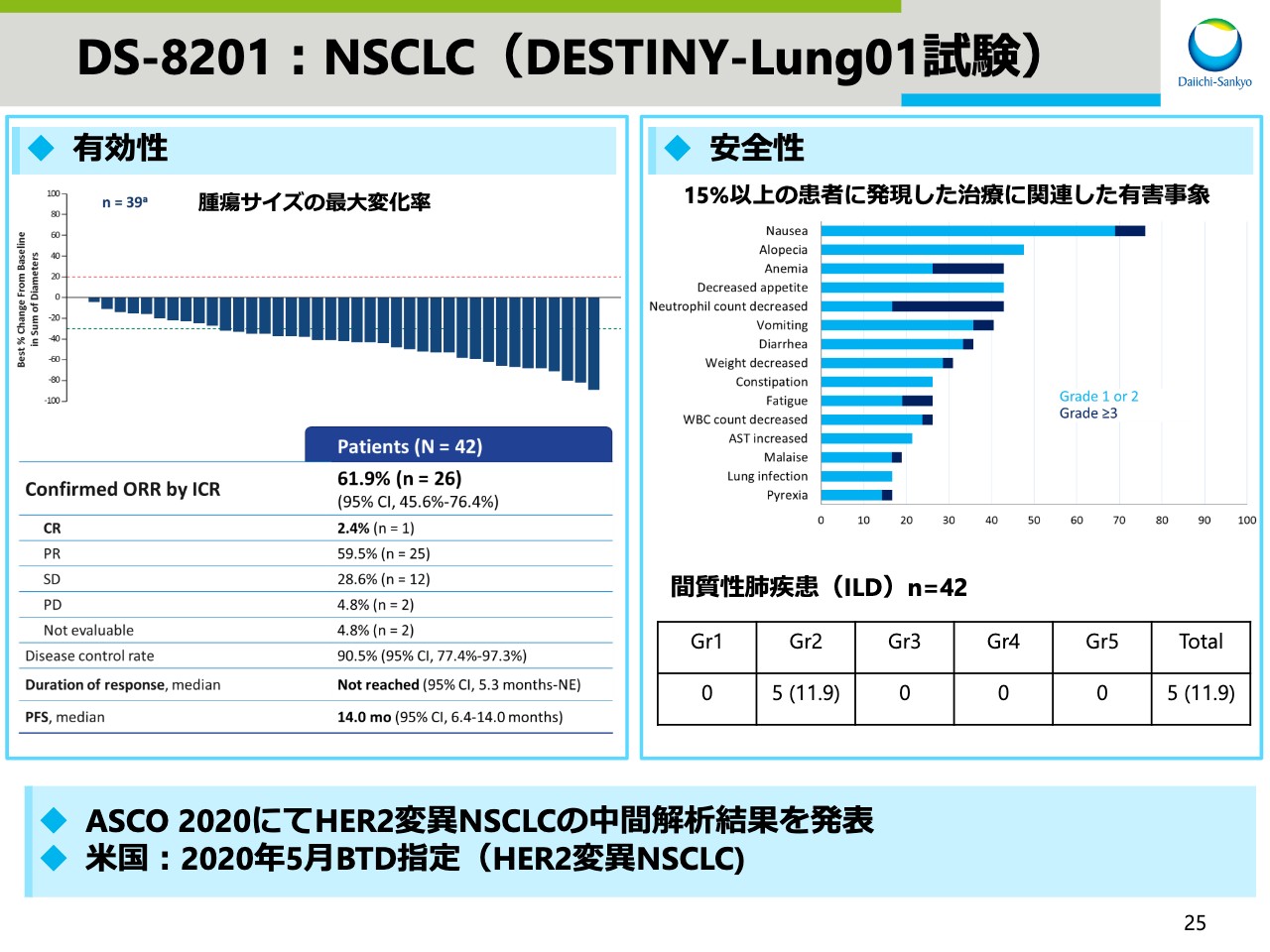
DS-8201:NSCLC(DESTINY-Lung01試験)
肺がんのデータです。HER2変異のある非小細胞肺がんのデータを発表しました。FDAからは、5月にブレークスルーセラピー指定を受けています。
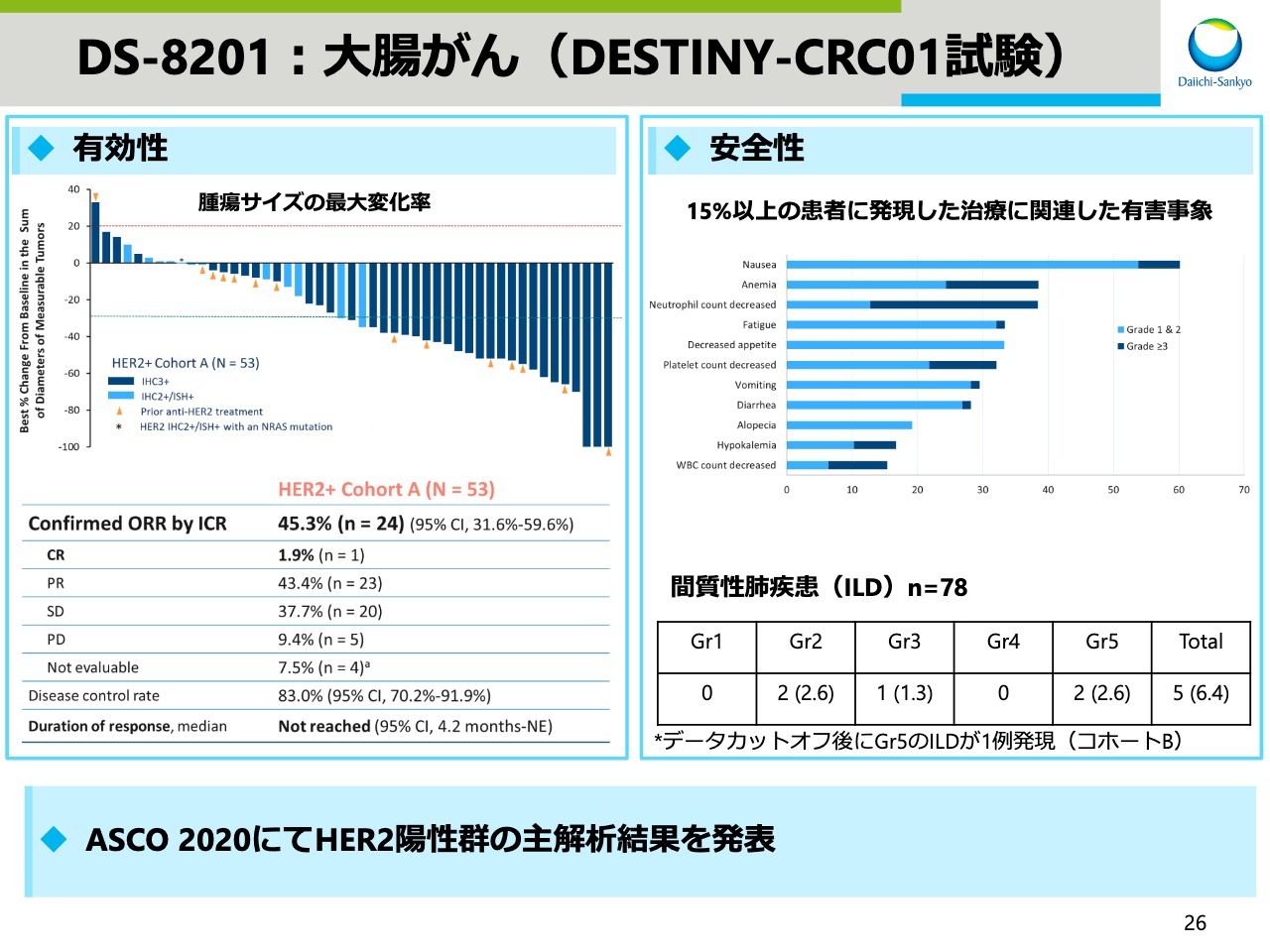
DS-8201:大腸がん(DESTINY-CRC01試験)
大腸がんのデータです。今後、ピボタル試験を実施し、早期に申請を目指します。
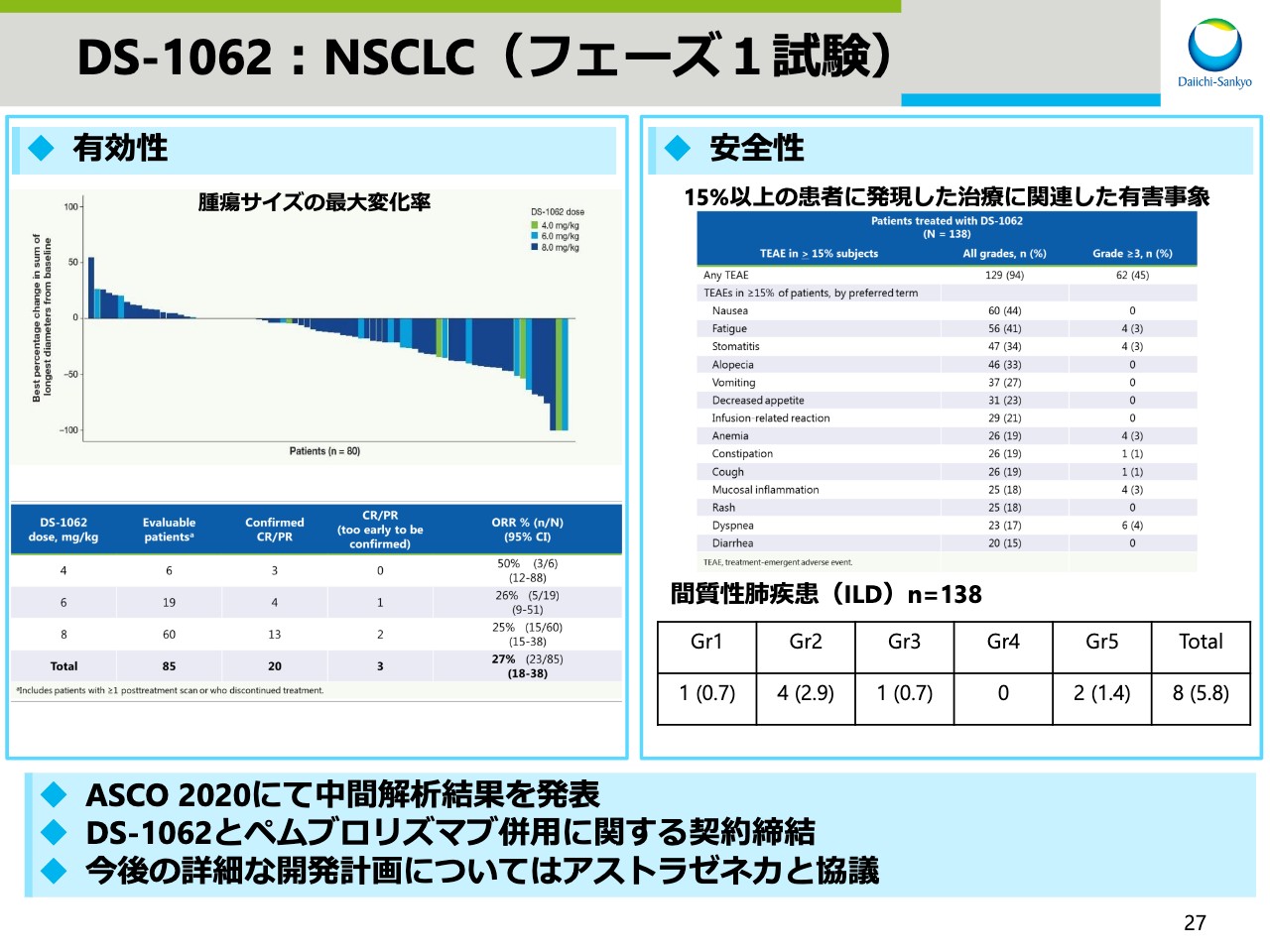
DS-1062:NSCLC(フェーズ1試験)
「DS-1062」のデータです。アストラゼネカと戦略的提携を行ないましたので、今後の開発計画については両社で協議し、作成していく予定です。
今後のニュースフロー
スライド29ページには、今後のニュースフローをまとめております。「DS-8201」については、乳がんの欧州申請が6月に受理されています。迅速審査の指定を受けていますので、今年度中の承認を見込んでいます。国内外については、先駆け審査指定品目のため、第4四半期の承認を見込んでおります。
「DS-1062」については2021年1月のWCLCで、フェーズ1試験のデータをアップデートする予定です。また、IO併用試験は、今年度下期より開始予定です。
「U3-1402」については、肺がんのデータを9月のESMOで、また、乳がんのデータを12月のサンアントニオ乳癌シンポジウムで発表予定です。新たな癌腫となる大腸がんのフェーズ2試験は、今年度下期より開始予定です。
その他の詳細については、スライドを後ほどご覧ください。
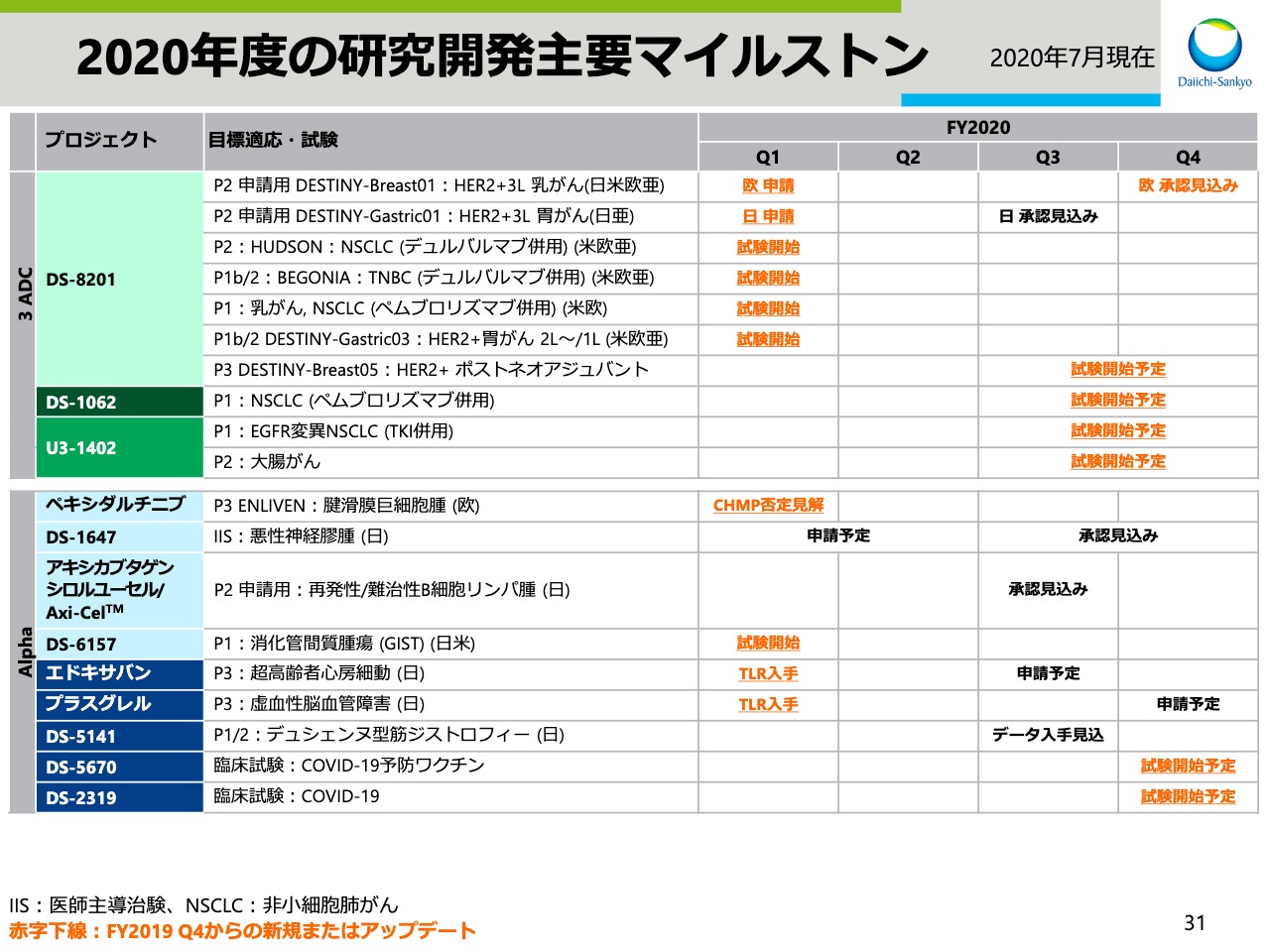
2020年度の研究開発主要マイルストン
スライド31ページ以降はアペンディックスです。マイルストン一覧やパイプライン一覧を掲載しておりますので、後ほどご確認をお願いいたします。
私からの発表は以上になります。