2020年1月31日に行われた、第一三共株式会社2020年3月期第3四半期決算説明会の内容を書き起こしでお伝えします。
スピーカー:第一三共株式会社 代表取締役副社長 CFO 齋寿明 氏\n第一三共株式会社 研究開発本部 高崎渉 氏
連結業績の概要
齋寿明氏:齋でございます。ご多忙のところご参加いただきありがとうございます。
本日の内容ですが、2019年度第3四半期の決算内容、2019年度業績予想、ビジネスアップデートの順番でお話します。その後、研究開発部長の高崎より研究開発アップデートについてお話いたします。
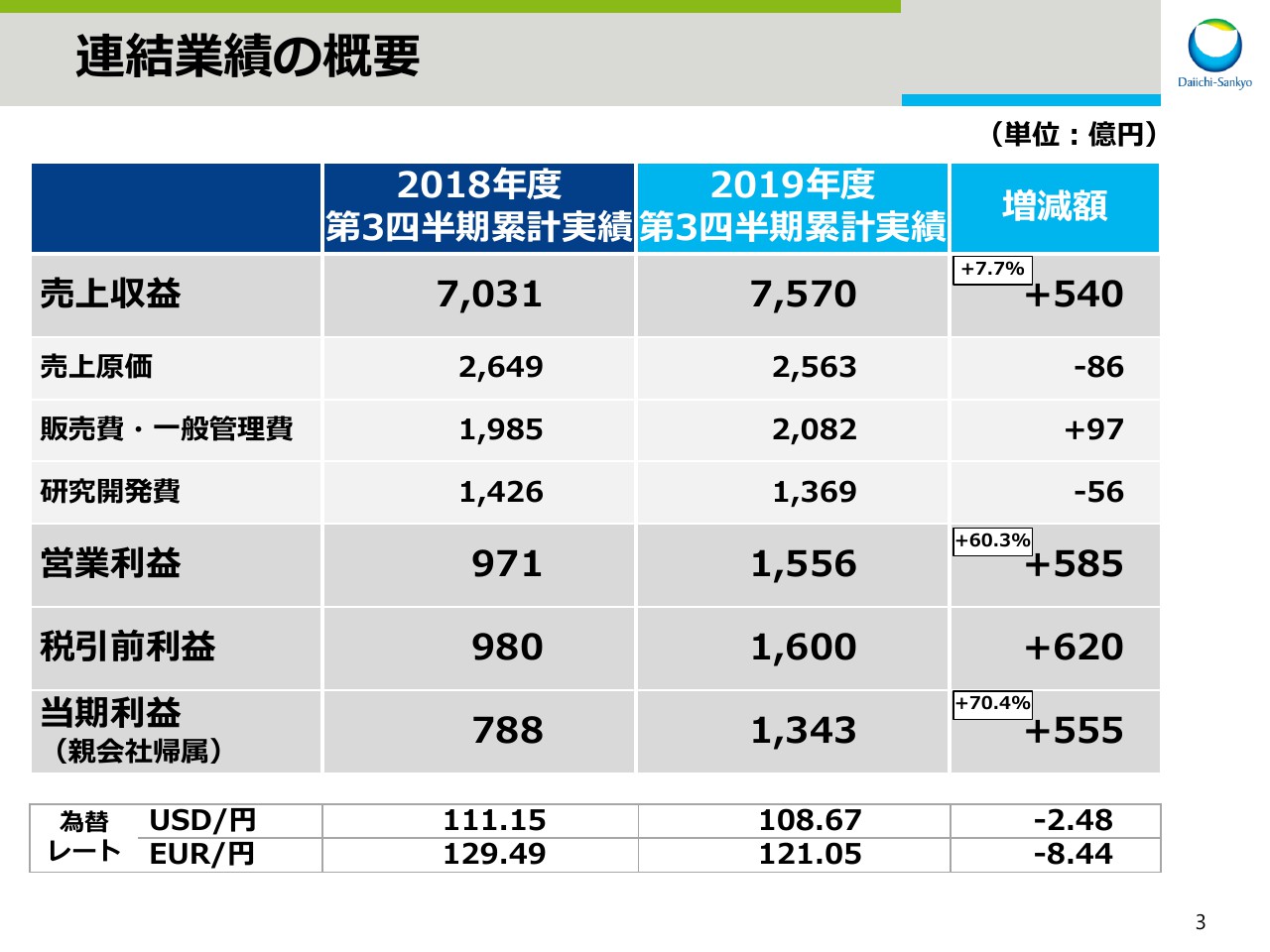
2019年度第3四半期の決算の概要です。連結売上収益は7,570億円。前年同期比540億円、7.7パーセントの増収となりました。売上原価は、前年同期比86億円減、販売費・一般管理費は97億円増、研究開発費は56億円減となりました。
この結果、営業利益は1,556億円で、前年同期比585億円増、60.3パーセントの増益となりました。税引前利益は前年同期比620億円増益の1,600億円、親会社株主帰属の当期利益は1,343億円、前年同期比555億円、70.4パーセントの増益となりました。
為替レートの実績です。1ドル108円67銭で、前期よりも2円48銭の円高です。1ユーロは121円5銭で、前年同期よりも8円44銭の円高となりました。
売上収益増減
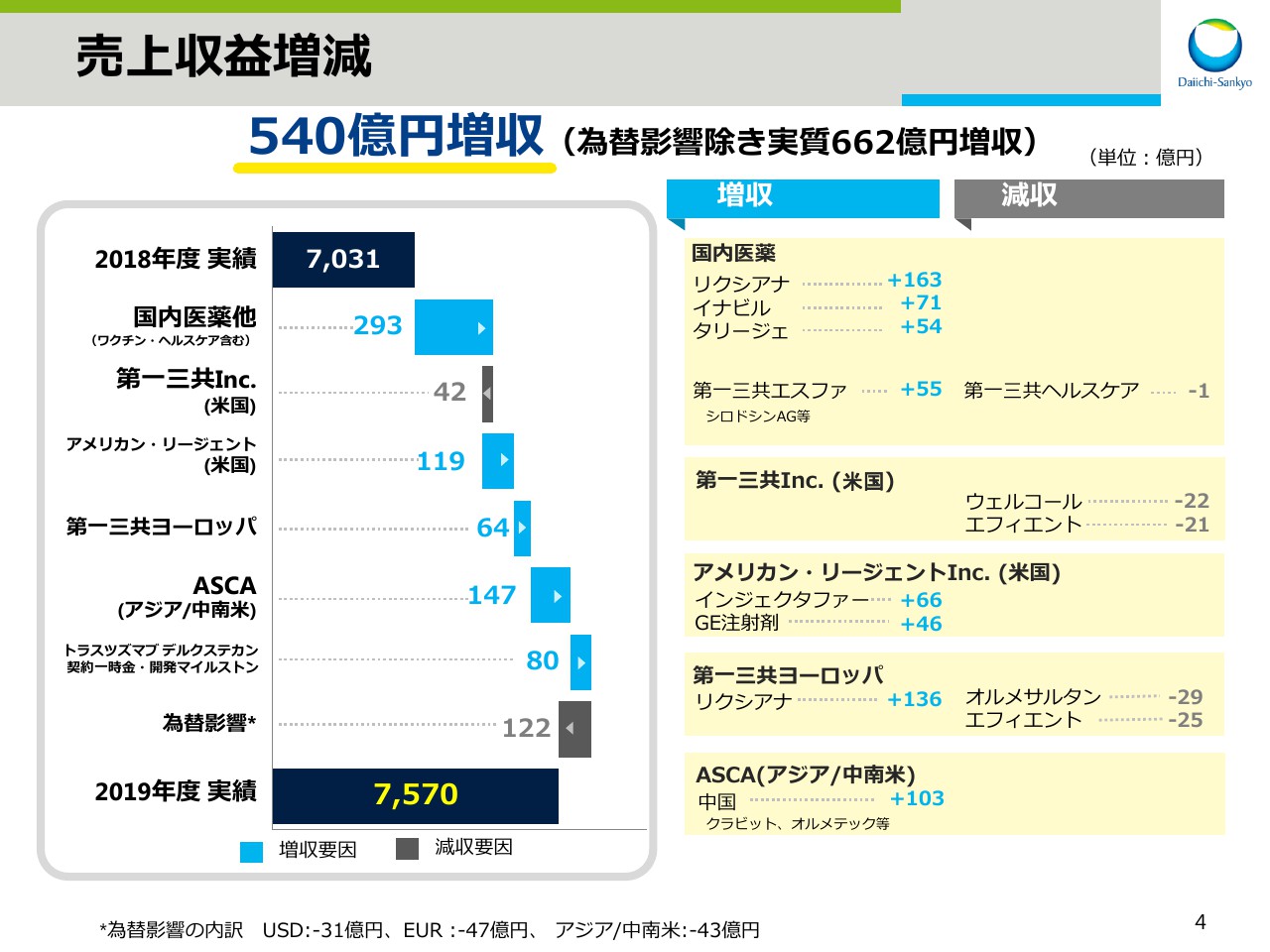
ここからは前年同期比での増減要因について説明いたします。売上収益は、前年同期比540億円の増収となりましたが、その内訳を主要事業ユニット別にご説明いたします。
まず、国内医薬です。ワクチン・ヘルスケアを含む日本事業では、直接経口抗凝固剤「リクシアナ」、抗インフルエンザウイルス剤「イナビル」、2019年4月に発売した疼痛治療剤「タリージェ」に加えまして、オーソライズドジェネリックを含めた第一三共エスファの商品を中心に売上を拡大しました。日本事業全体では293億円の増収となりました。
次に、海外営業について説明いたします。スライドでは、為替変動の影響を除外したかたちで記載しています。
米国の第一三共Inc.は、高コレステロール血症治療剤・2型糖尿病治療剤「ウェルコール」、抗血小板剤「エフィエント」の減収等により、42億円の減収となりました。
一方、米国のアメリカン・リージェントInc.は、ジェネリック注射剤および鉄欠乏性貧血治療剤「インジェクタファー」の伸長により、119億円の増収。
第一三共ヨーロッパは「オルメサルタン」「エフィエント」の減収があったものの、「リクシアナ」の売上拡大により64億円の増収となりました。
続いて、アジア中南米地域を担当するASCA事業です。中国で「オルメテック」「クラビット」を中心に103億円の増収となり、ASCA事業全体では147億円の増収となりました。
また、2019年3月にアストラゼネカ社と契約を締結したDS-8201、トラスツズマブ デルクステカンの契約一時金。また米国承認取得に伴う開発マイルストンの、第3四半期までの認識分として約80億円を計上し、増収となりました。
なお、為替による減収は全体で122億円でございました。
営業利益増減
スライドは営業利益の増減要因を示しております。585億円の増益について、項目別にご説明いたします。先ほどの説明の通り、売上収益は為替影響による減収122億円を含めて、540億円の増収となりました。
次に経費関連を為替影響・特殊要因を除いて説明いたします。売上原価については、売上収益の増収に伴う原価増となったものの、プロダクトミックスにより原価率が大幅に改善したことで、77億円増に留まりました。
販売費・一般管理費は、米国におけるがん事業体制構築に伴う費用増等により、214億円の増となりました。
研究開発費は、トラスツズマブ デルクステカンに係るアストラゼネカ社とのコストシェアの影響がありましたが、がんPJ開発体制の強化に伴う費用増により37億円減に留まりました。
為替影響による費用減は、合計で91億円でした。特殊要因としては、前期と比較すると208億円の費用減となりました。
なお、為替と特殊要因による影響を除外すると、実質で408億円の増益です。
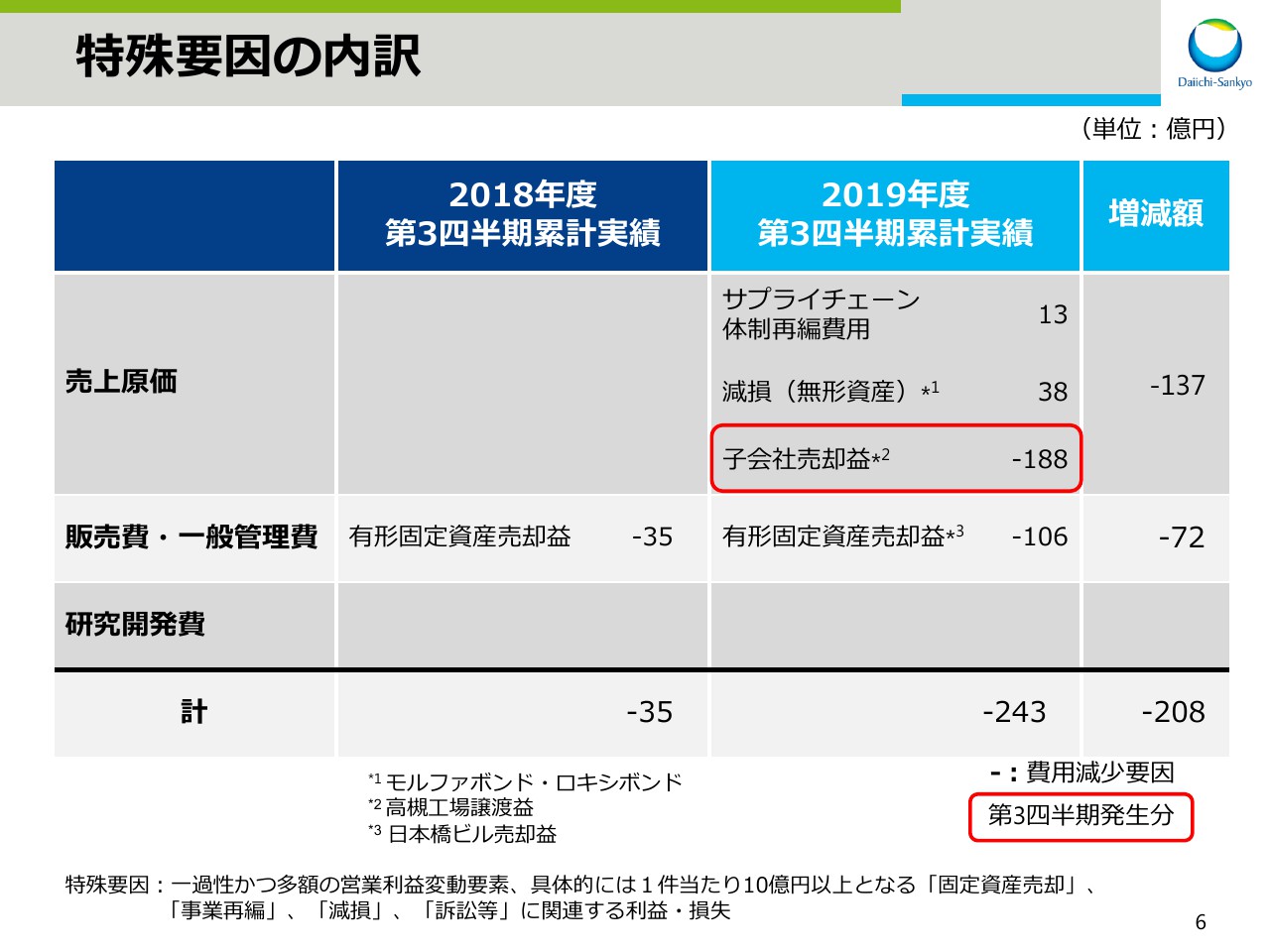
特殊要因の内訳
特殊要因の内訳です。モルファボンド・ロキシボンドに係る無形資産の減損を38億円計上したものの、高槻工場譲渡に伴う子会社売却益により188億円、有形固定資産売却による106億円の費用減があり、243億円の費用減となりました。
この結果、今期は前期に比べ208億円の費用減となりました。
当期利益(親会社帰属)増減
当期利益に関して説明いたします。営業利益は先ほどの説明の通り、為替と特殊要因による影響も含め585億円の増益となりました。
法人税等は連結納税制度の導入に伴い税率が減少したため、66億円の増加に留まりました。その結果、親会社帰属の当期利益は1,343億円、前年同期比555億円の増益となりました。
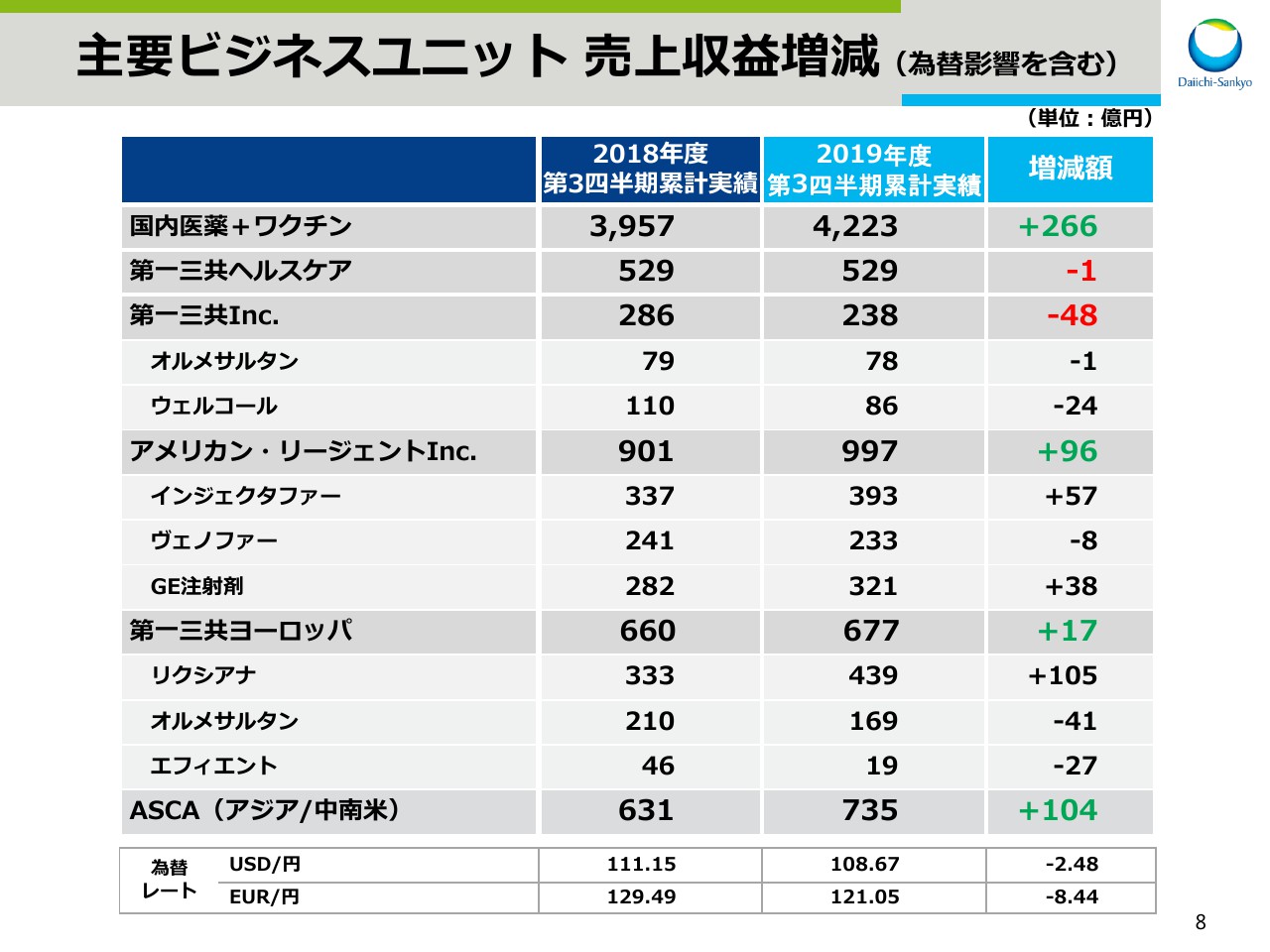
主要ビジネスユニット 売上収益増減(為替影響を含む)
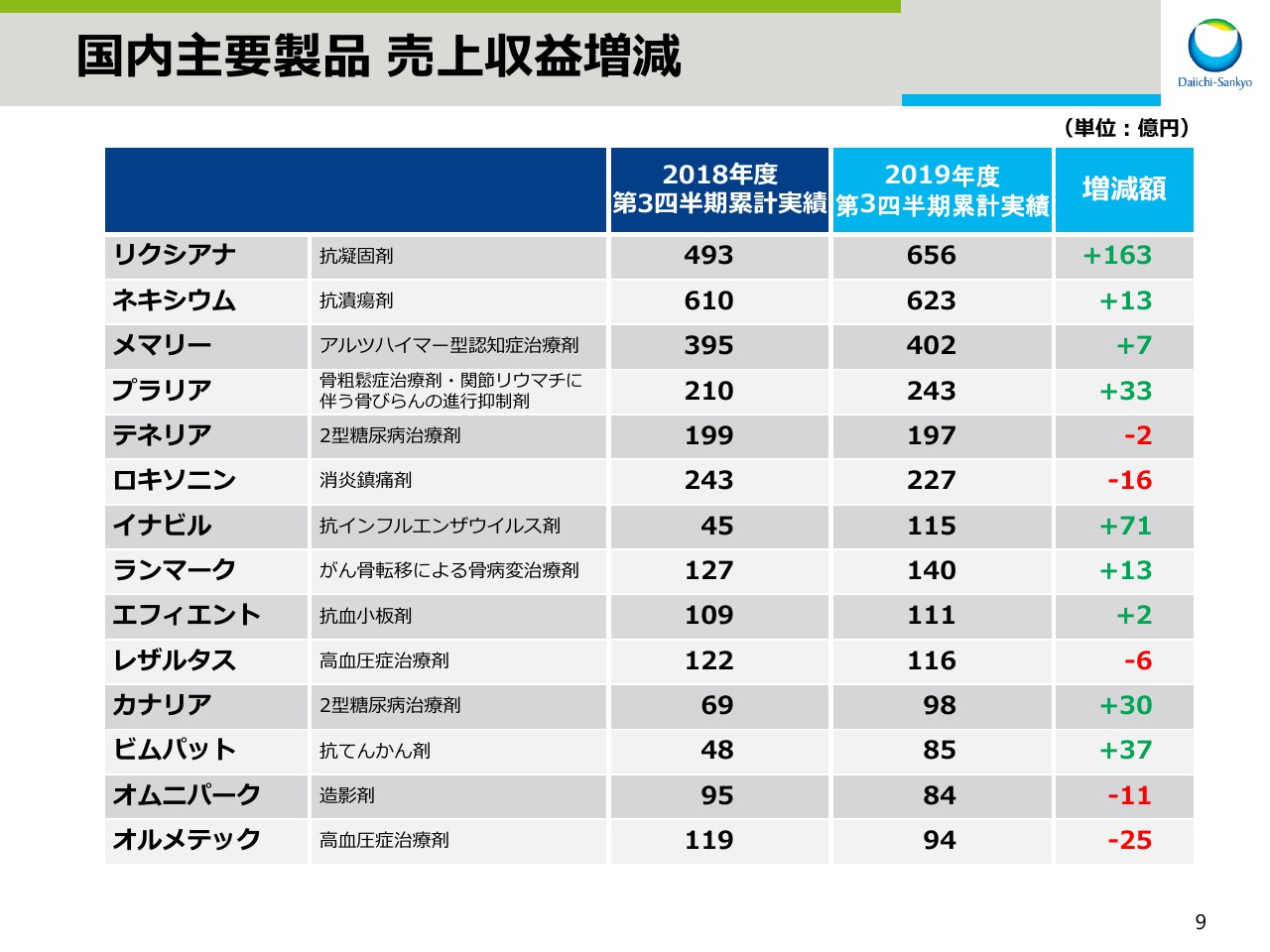
国内主要製品 売上収益増減
スライド8と9は、主要ビジネスユニット、国内主要製品の円ベースでの売上増減でございます。
先ほどのスライド4では、為替影響を除いた各ユニットの状況をご説明しましたが、ここでは為替影響を含んだ実績を示しております。
業績予想の修正
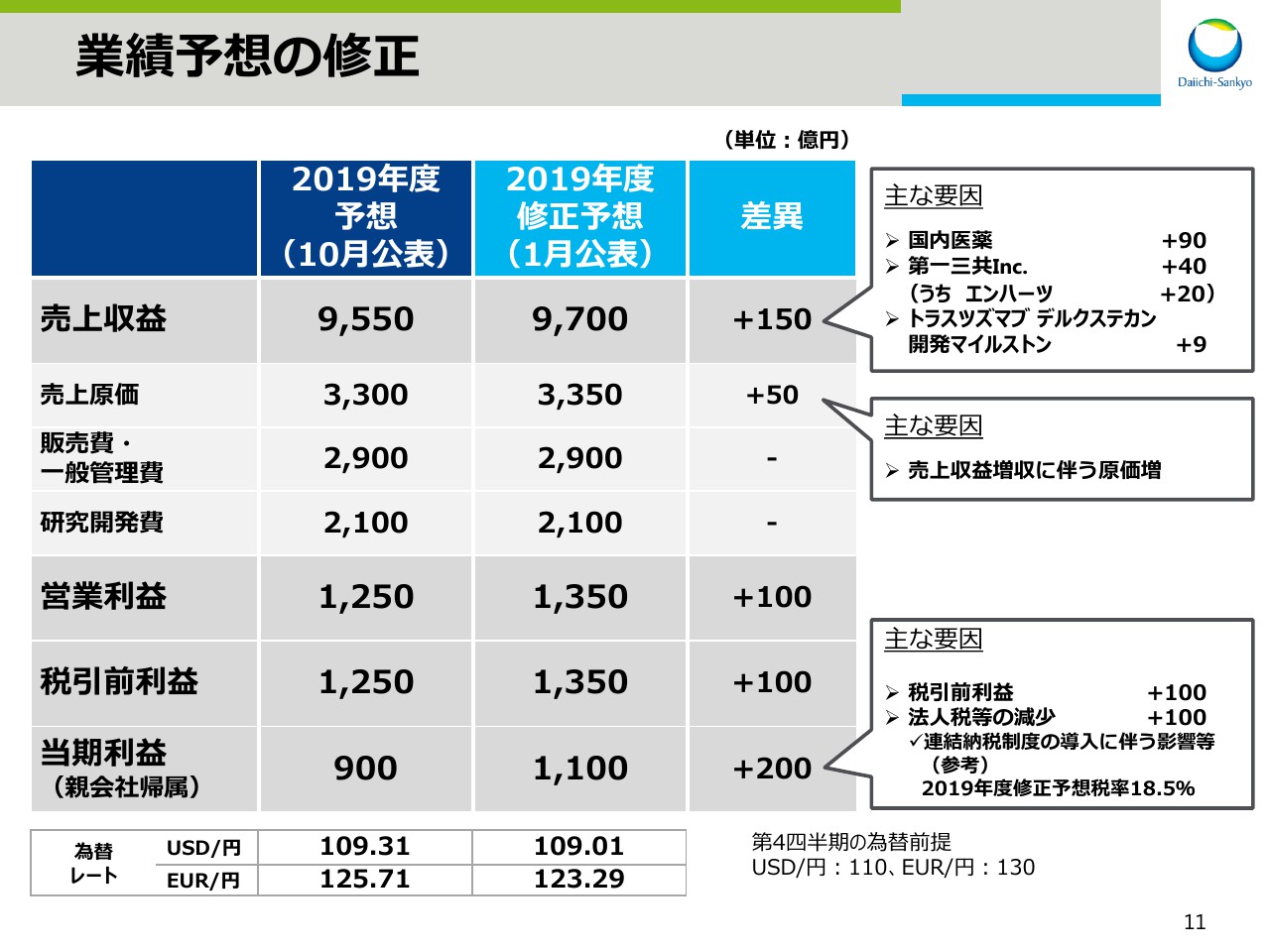
2019年度業績予想の修正についてお話します。
売上収益は国内医薬、英国において製品売上が堅調に推移していることに加え、「エンハーツ」の米国承認上市時期が当初の想定より前倒しとなったことから、150億円上方修正し、年間で9,700億円としています。
売上収益増収に伴い売上原価の費用増50億円を見込み、営業利益ベースでは100億円上方修正し、1,350億円とします。
また、連結納税制度の導入に伴う影響等によりまして、法人税等で100億円の費用減を見込み、結果、親会社帰属の当期利益を200億円上方修正し、年間で1,100億円とします。
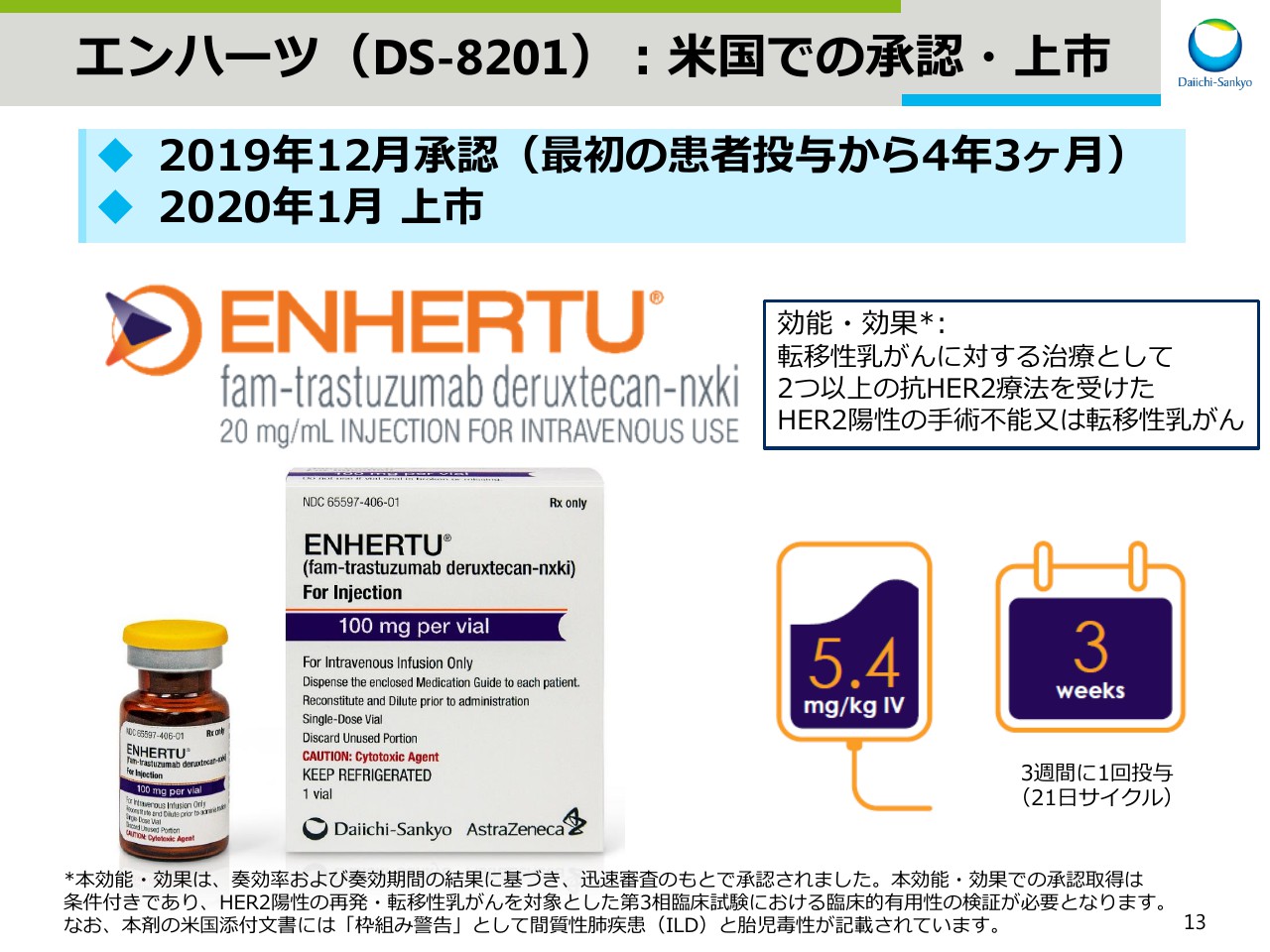
エンハーツ(DS-8201):米国での承認・上市
ビジネスアップデートをお話します。2015年9月に初めて患者さんに投与されてから、4年3ヶ月という記録的なスピードで、2019年12月に承認を取得いたしました。
今月から製品名「エンハーツ」として上市しております。3次治療以降の新たな選択肢として、患者さんへお届けします。
今後、今回の米国だけではなく他の国々、また他の適応症においても、開発を促進し、加速し、より早くより多くの患者さんへお届けできるようにします。
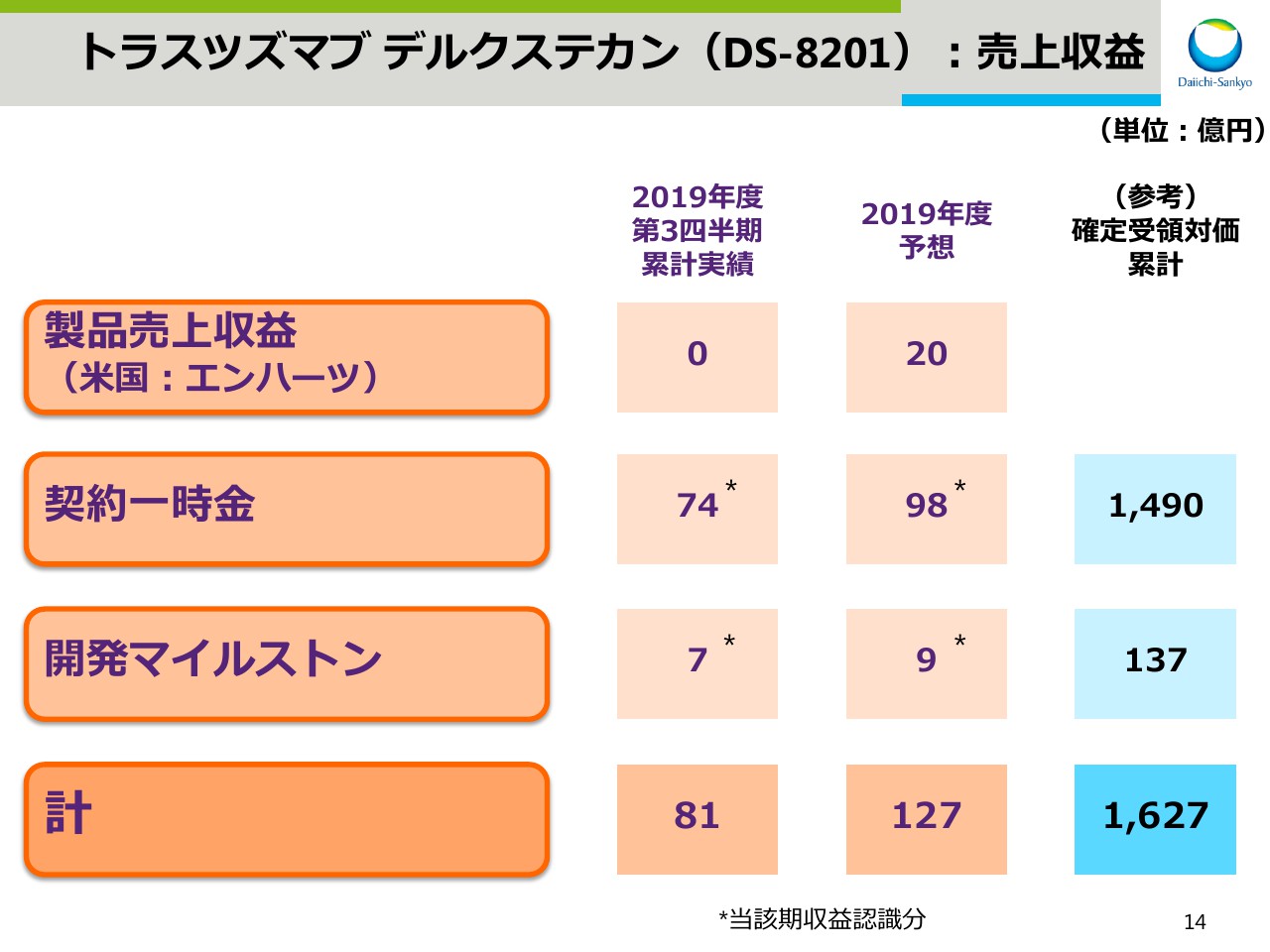
トラスツズマブ デルクステカン(DS-8201):売上収益
スライドは、DS-8201の売上収益の内訳をまとめました。
2019年度第3四半期までの累計実績において、米国エンハーツの製品売上収益は2,000万円ほどありましたが、四捨五入してゼロと表示しております。これに契約一時金、開発マイルストンを加え、合計で81億円となりました。
2019年度の業績予想では、米国エンハーツの製品売上収益を含め、127億円を見込んでおります。ご参考までに、すでに確定している事業対価の合計額は1,627億円であります。
ここからは研究開発費アップデートです。研究開発本部長の高崎にバトンタッチします。
DS-8201:DESTINY-Gastric01試験結果
高崎渉氏:高崎でございます。本日は私より研究開発のアップデートについてお話いたします。
スライドは、DS-8201の日本および韓国で実施していたDESTINY-Gastric01胃がん試験のトップラインリザルトでございます。
本試験は対象群を置いた二重盲検試験で、DS-8201にとって初めて対象群との比較データが得られた試験です。
DS-8201:DESTINY-Gastric01試験結果
スライドに結果を示しています。2020年1月27日にプレスリリースですでにご紹介した通り、本試験の主要評価項目である客観的奏効率(ORR)および副次評価項目である全生存期間(OS)の中間解析において、DS-8201投与分は治験医師選択薬投与群に対し統計学的に有意かつ臨床的意義の高い改善を示しました。
また本試験において安全性上の新たな懸念は認められませんでした。間質性肺疾患(ILD)および肺臓炎については薬剤との関係がある症例の大半はグレード1または2で、グレード3が2例、グレード4が1例発生したものの、グレード5の死亡例の報告はありませんでした。
本試験結果をもとに、2020年度第1四半期に日本において承認申請予定です。また結果の詳細はASCO2020で発表予定です。
本日のフォーカス
スライドは、2019年12月のR&D Day 2019でご紹介した新しい戦略です。本日はAlphaのうちスペシャルティ・メディスンにフォーカスしてお話いたします。
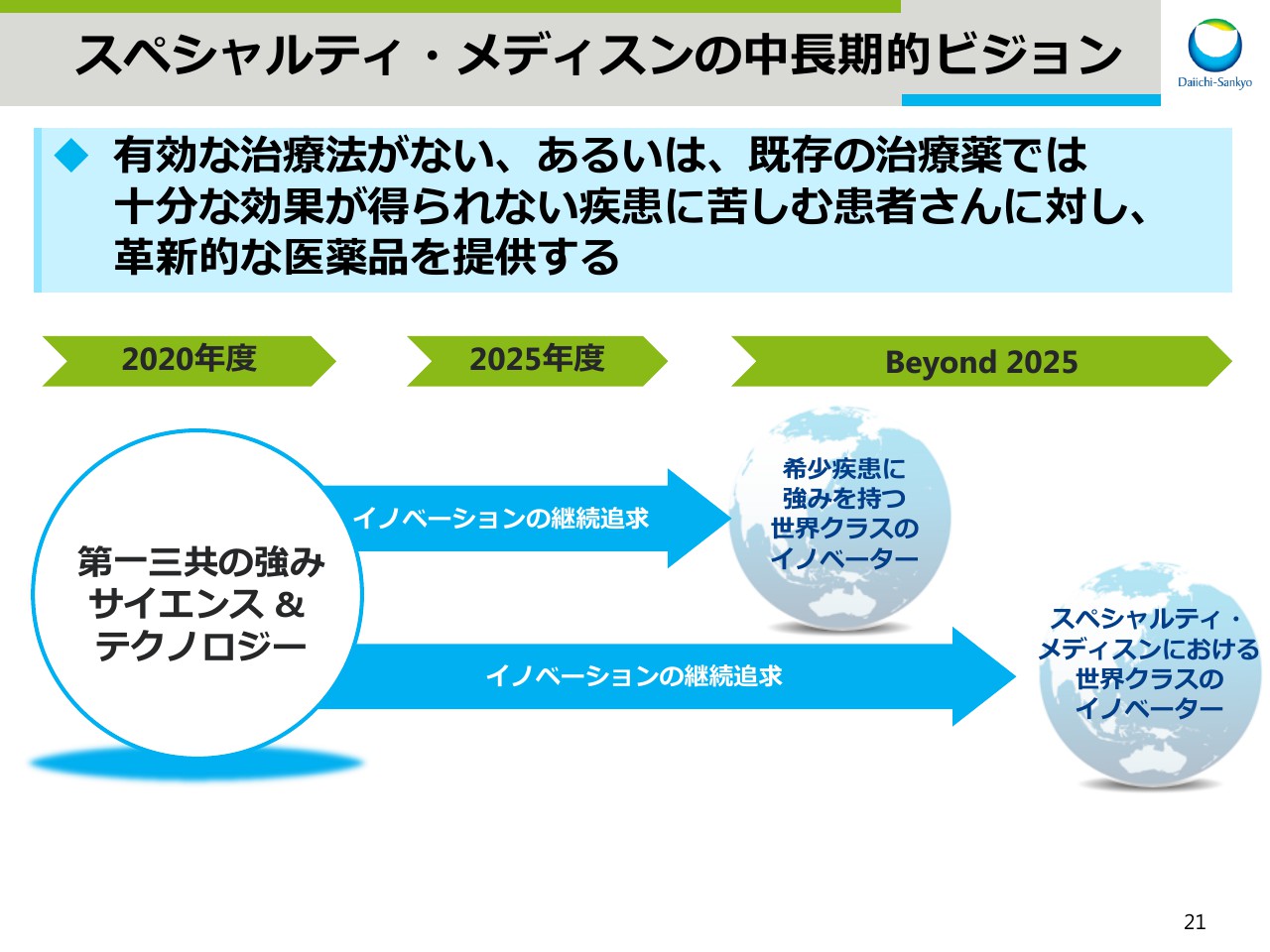
スペシャルティ・メディスンの中長期的ビジョン
スペシャルティ・メディスンの中長期的ビジョンです。当社の研究開発全体目標でもありますが、スペシャルティ・メディスン領域においても、有効な治療法がない、あるいは、既存の治療薬では十分な効果が得られない疾患に苦しむ患者さんに対し、革新的な医薬品を提供することを目標に掲げております。
後ほどご紹介いたしますが、希少疾患領域のパイプラインが充実してきており、2020年度以降順次、認証入します。
まずは2025年度以降、希少疾患における世界クラスのイノベーターになることを目指し、将来的にはスペシャルティ・メディスンにおける世界クラスのイノベーターになることを目指します。
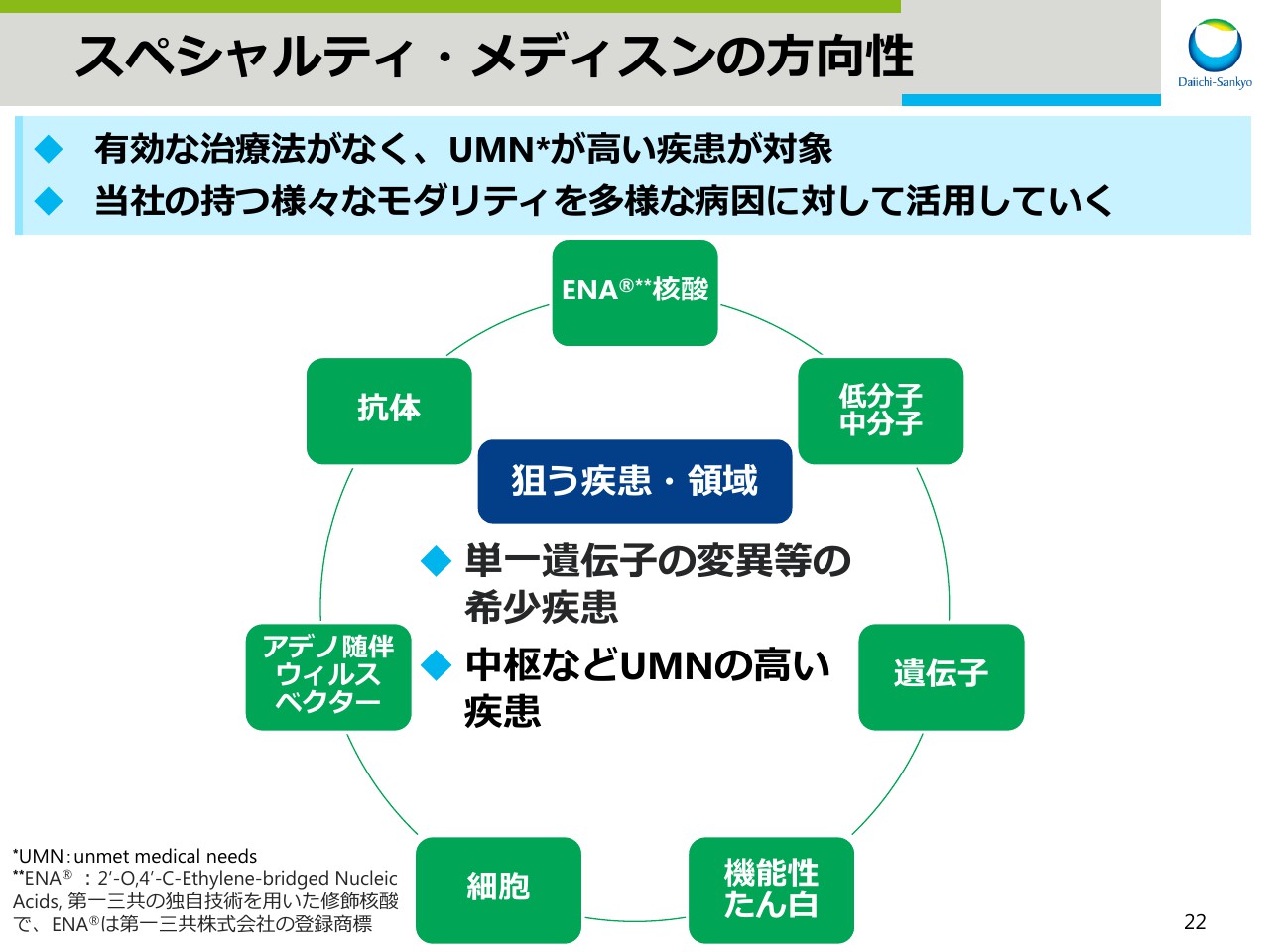
スペシャルティ・メディスンの方向性
スペシャルティ・メディスンの方向性についてご説明いたします。有効な治療法がなく、アンメットメディカルニーズが高い疾患を対象とし、また当社の持つ様々なモダリティを多様な病因に対して活用していく方針です。
狙う疾患・領域は単一遺伝子の変異等の希少疾患や、中枢などアンメットメディカルニーズの高い疾患です。本日はいくつかの希少疾患プロジェクトについてご紹介させていただきます。
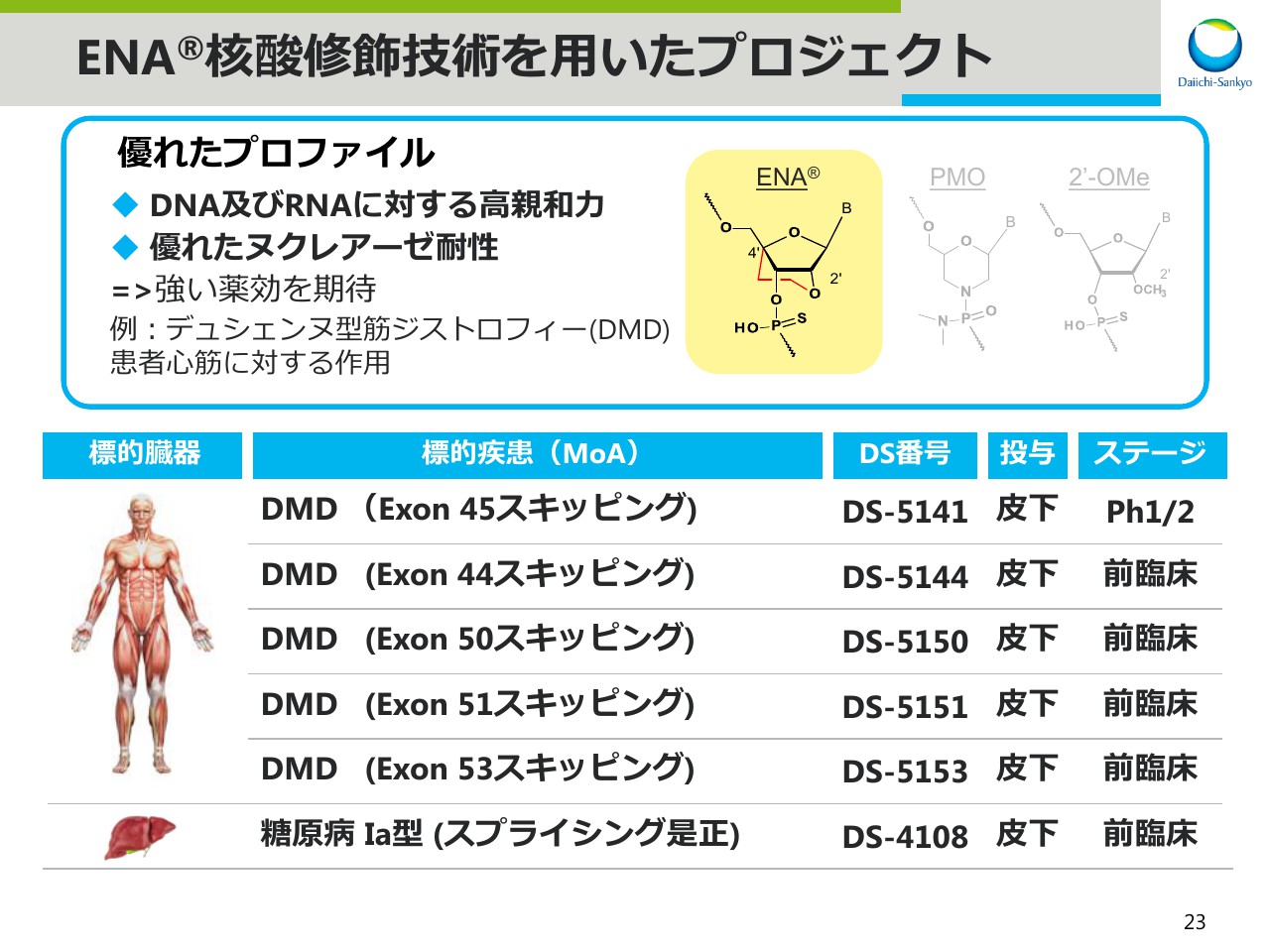
ENA®核酸修飾技術を用いたプロジェクト
まず、第一三共のオリジナル技術を用いた修飾核酸ENAを用いたプロジェクトについてご紹介します。
当社のENAは他の核酸と比較し、DNAやRNAに対する親和性が高く、また優れたヌクレアーゼ耐性があります。これらの特徴から強い薬効を期待しております。
ENA技術を用いたプロジェクトは、現在フェーズ1/2試験を実施しているDS-5141を筆頭に、6つのプロジェクトがあります。
DXd-ADCの次のプラットフォーム技術になることを期待しております。
ENA®核酸修飾技術を用いたプロジェクト:DS-5141
スライドは、DS-5141の標的疾患であるデュシェンヌ型筋ジストロフィーの概要を示しております。
DS-5141は、有効性の主要評価項目を達成すべく、現在48週間の投与試験を行なっております。ドップラインリザルトは2020年末の入手を予定しています。
疾患の詳細については、本日は割愛させていただきます。
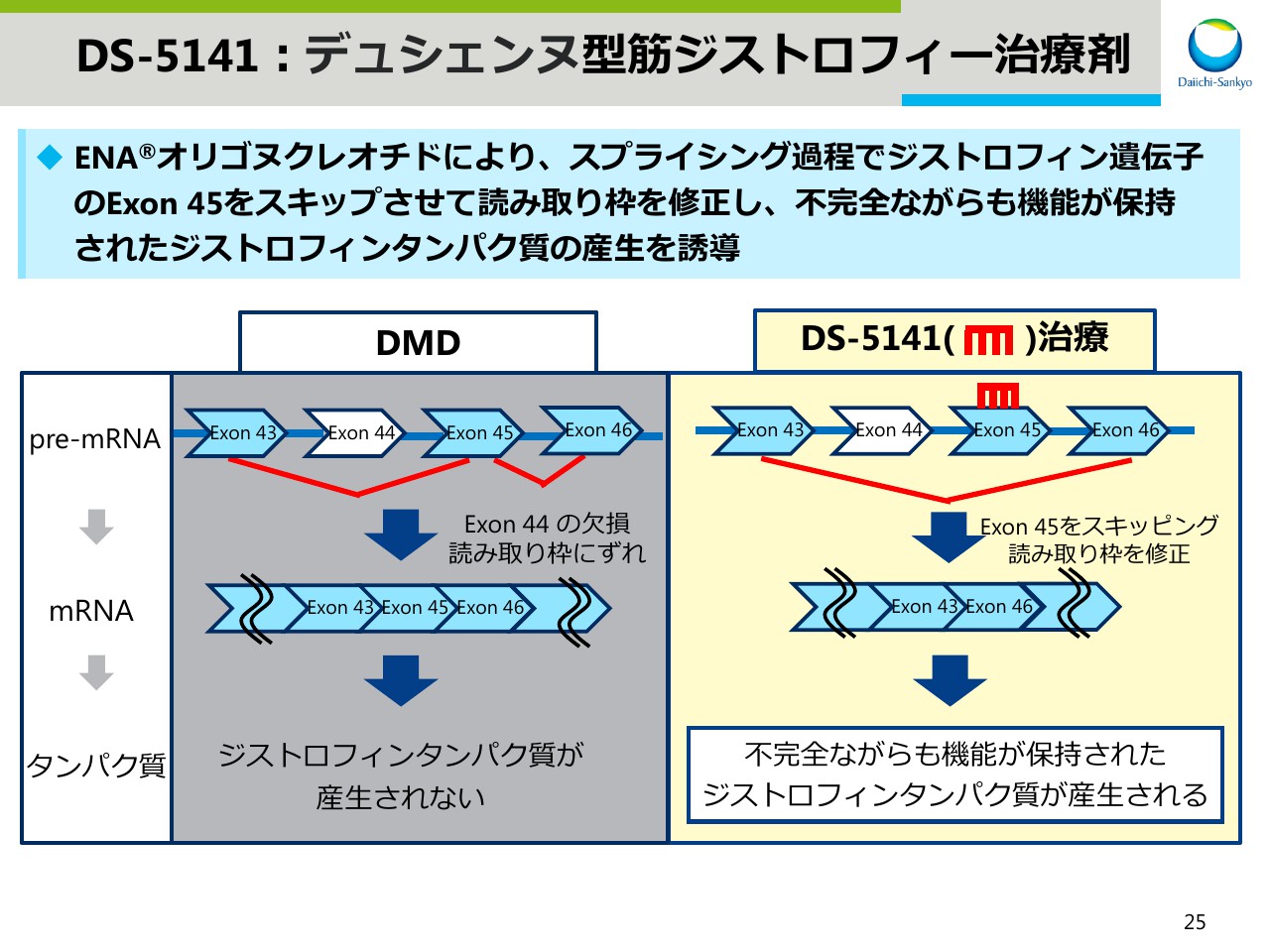
DS-5141:デュシェンヌ型筋ジストロフィー治療剤
スライドは、DS-5141の作用機序を示しております。DMDの患者さんではExon 44の欠損があります。
DS-5141はスプライシング過程でExon 45をスキッピングさせることで、読み取り枠を修正し、不完全ながらも機能が保持されたジストロフィンタンパク質の産生を誘導します。
12週間投与試験では、明確なスキッピング活性が見られておりましたので、先ほど述べましたように、現在48週間投与試験にて主要評価項目を達成できるか否かを確認中です。
ENA®核酸修飾技術を用いたプロジェクト:DS-4108
神戸学院大学、国立成育医療研究センター、広島大学との共同研究をしておりますDS-4108の標的疾患である、糖原病Ⅰa型の概要です。
糖原病Ⅰa型は遺伝子の先天的な機能欠損により、空腹時低血糖や肝腫大などを起こす疾患です。
この疾患は承認された薬物療法がなく、厳格な食事療法で管理をしています。糖原病Ⅰa型は10万人に1人の割合で生まれておりますが、DS-4108の対象になるのはさらに限られています。
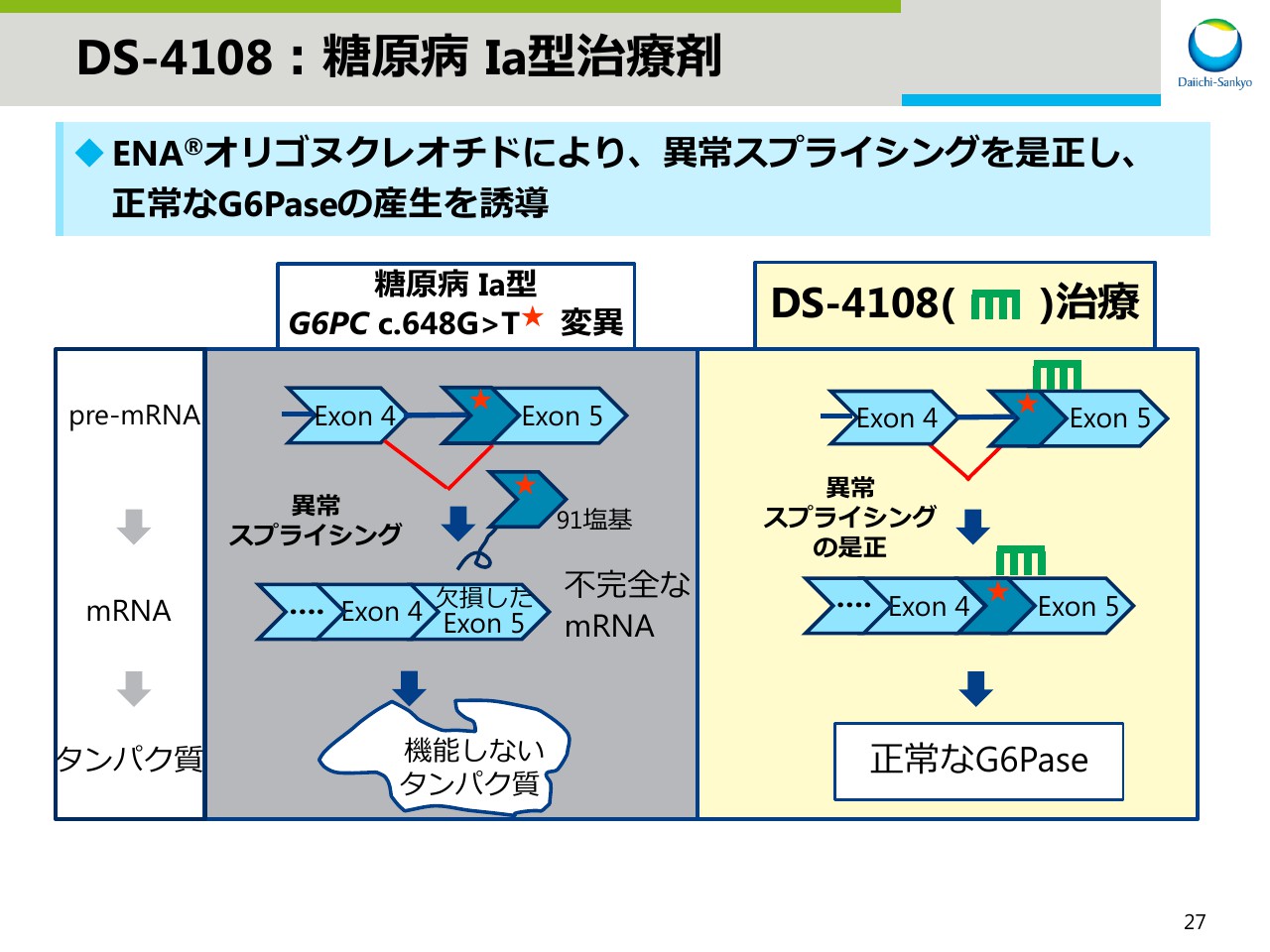
DS-4108:糖原病 Ia型治療剤
DS-4108の作用機序を示しています。異常スプライシングをDS-4108で是正することで、正常なタンパク質再生を誘導します。
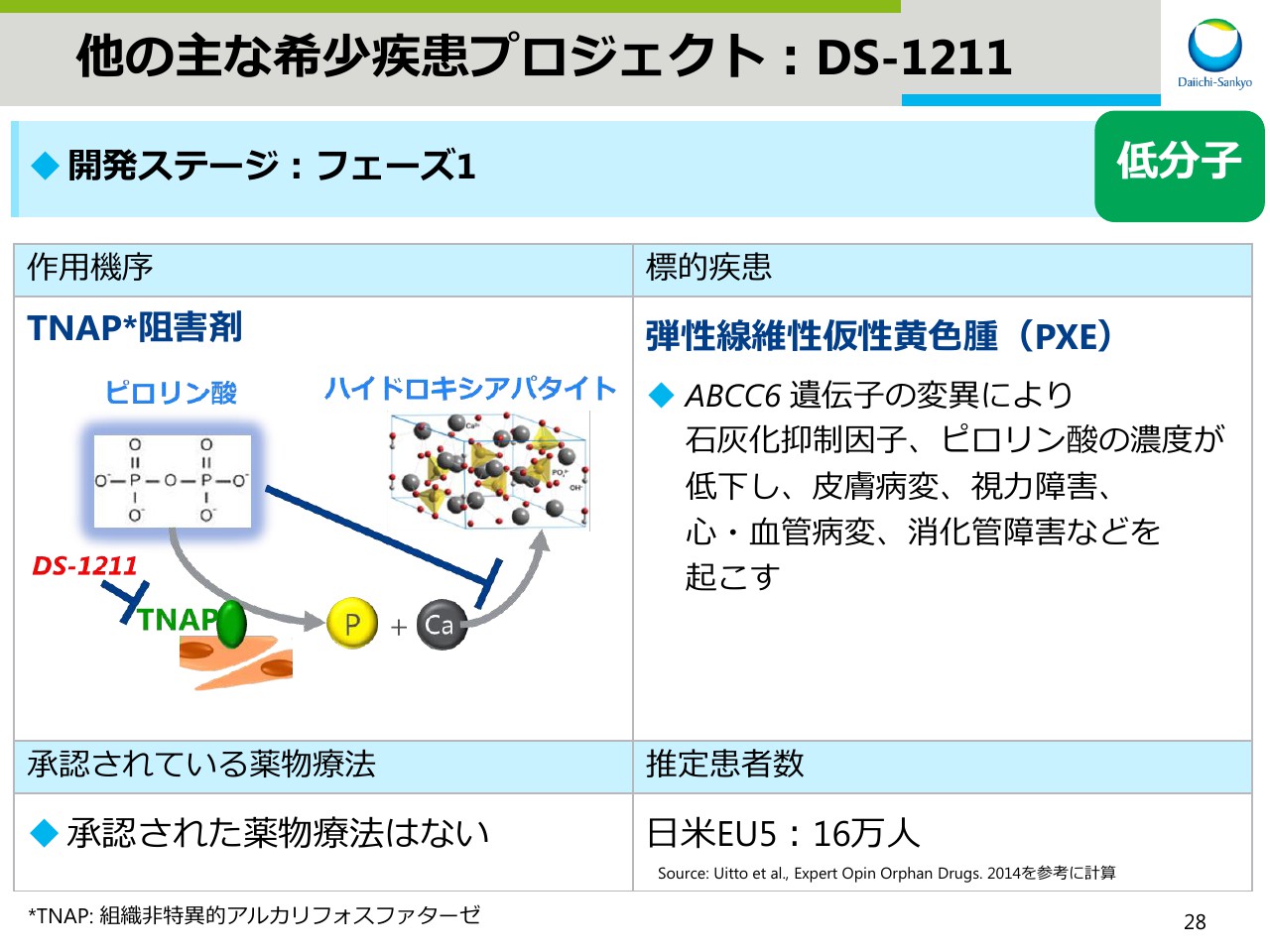
他の主な希少疾患プロジェクト:DS-1211
ここからは、希少疾患のプロジェクトを2つ、希少疾患以外のプロジェクトを1つ紹介いたします。
まずはTNAP阻害剤DS-1211です。標的疾患は弾性繊維性仮性黄色腫で、遺伝子の変異により皮膚の病変や視力低下、心・血管合併症などを引き起こす疾患です。
承認された薬物療法はなく、推定患者数は日米欧州5ヶ国で16万人です。現在フェーズ1試験を実施中です。
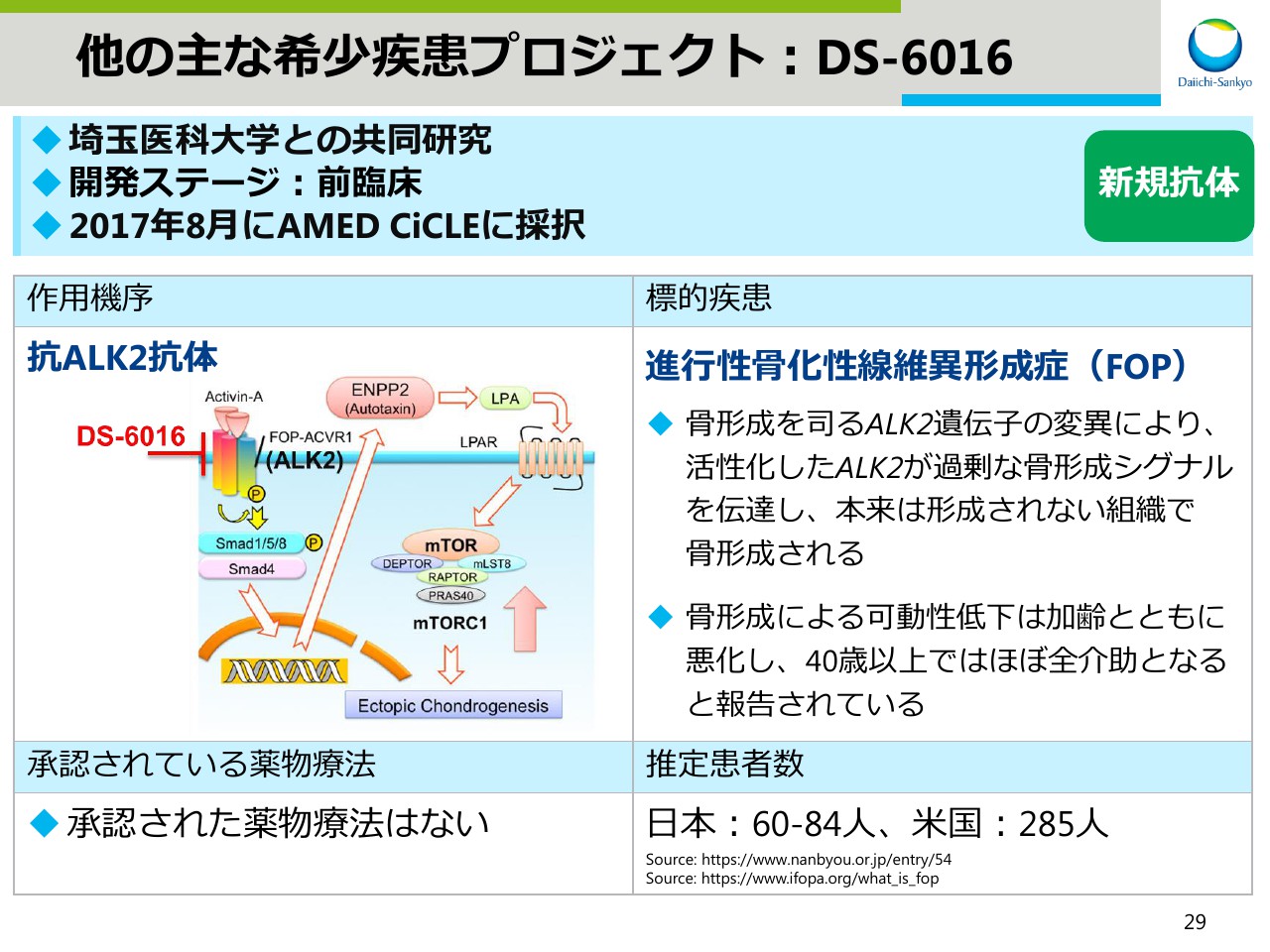
他の主な希少疾患プロジェクト:DS-6016
埼玉医科大学と共同研究を行なっている抗ALK2抗体のDS-6016です。本プロジェクトは2017年8月にAMED CiCLEに採択された際、一度プレスリリースを行いご紹介いたしました。
標的疾患は、進行性骨化性線維異形成症です。骨形成を司る遺伝子の変異により、本来は形成されない組織で骨形成される疾患であります。
骨形成は加齢とともに悪化して、40歳以上ではほぼ全介助が必要になると報告されております。
現在、承認された薬物療法はなく、推定患者数は日本で80名弱、米国でも300名弱と非常に稀な疾患です。現在、前臨床試験を進めております。
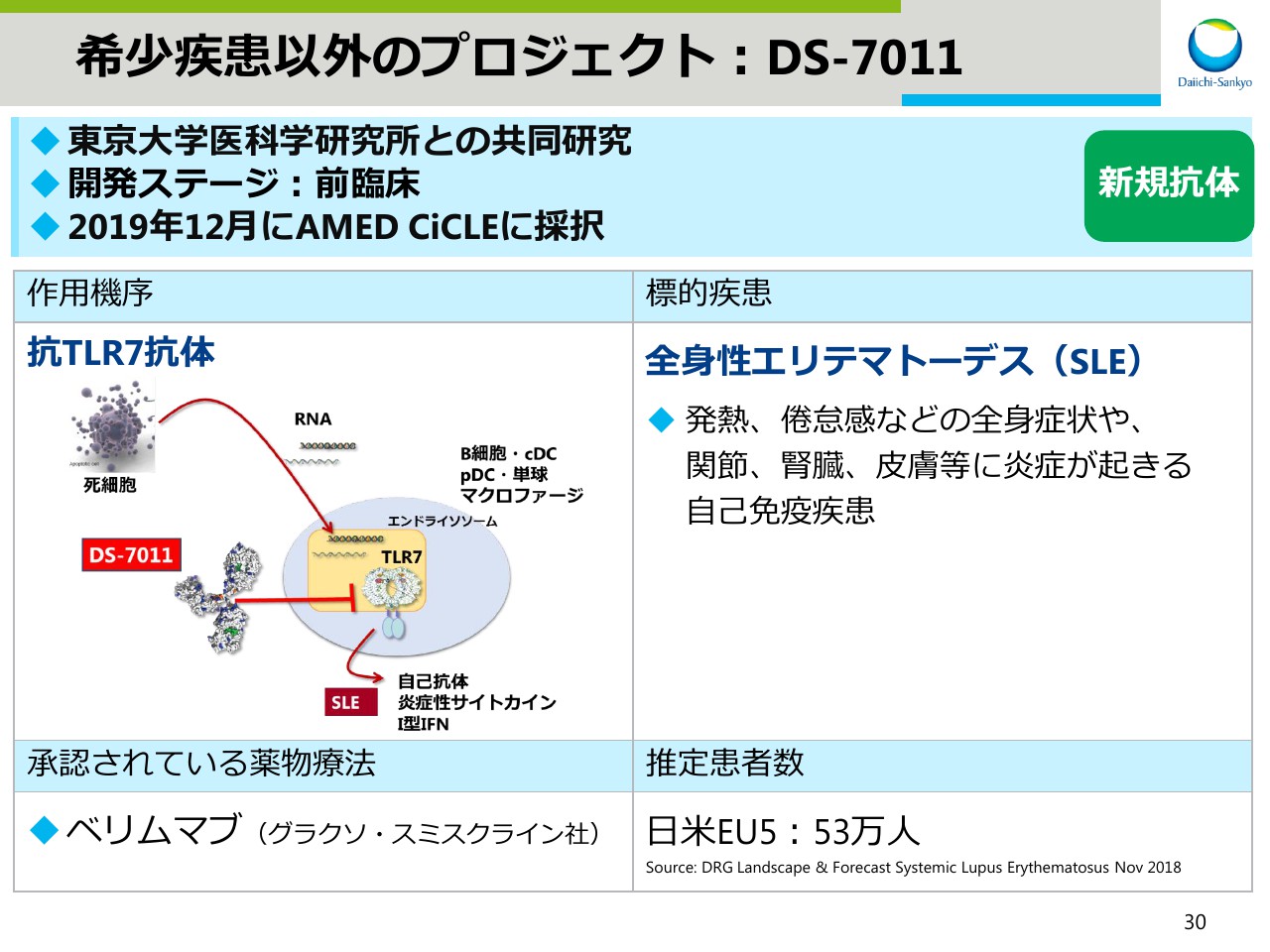
希少疾患以外のプロジェクト:DS-7011
東京大学医科学研究所との共同研究を行なっている抗TLR7抗体のDS-7011です。希少疾患プロジェクトではありませんが、2019年12月にAMED CiCLEに採択されたプロジェクトです。
標的疾患は、全身性エリテマトーデス(SLE)です。SLEは発熱、倦怠感などの全身症状や、関節、腎臓、皮膚等に炎症が起きる自己免疫疾患です。
承認された薬物療法はあるものの、未だアンメットメディカルニーズの高い疾患であります。 現在、前臨床試験を実施中です。
3ADC:今後のニュースフロー
3ADCの今後のニュースフローを紹介しております。内容としては、2019年12月のR&D DAYでお知らせした内容と大きく変わりませんが、1点だけ修正させていただきます。
R&D DAYの際、DS-8201とニボルマブ併用のフェーズ1試験の途中経過について、2020年のASCOで発表予定とお伝えしておりましたが、試験の進捗と内容を鑑み、より適切なタイミングの媒体を探すことにしました。
その他の内容については、後ほどご確認ください。
Alpha:今後のニュースフロー
スライドは、Alphaの今後のニュースフローで、こちらも以前から変更はありません。私からの発表は以上です。