2020年2月13日に行われた、株式会社ヘリオス2020年12月期決算説明会の内容を書き起こしでお伝えします。
スピーカー:株式会社ヘリオス 代表執行役社長CEO 鍵本忠尚 氏
基本戦略
鍵本忠尚氏:みなさま、おはようございます。それでは、2019年12月期の決算説明を始めたいと思います。あらためまして、代表執行役社長の鍵本忠尚でございます。本日はよろしくお願いします。
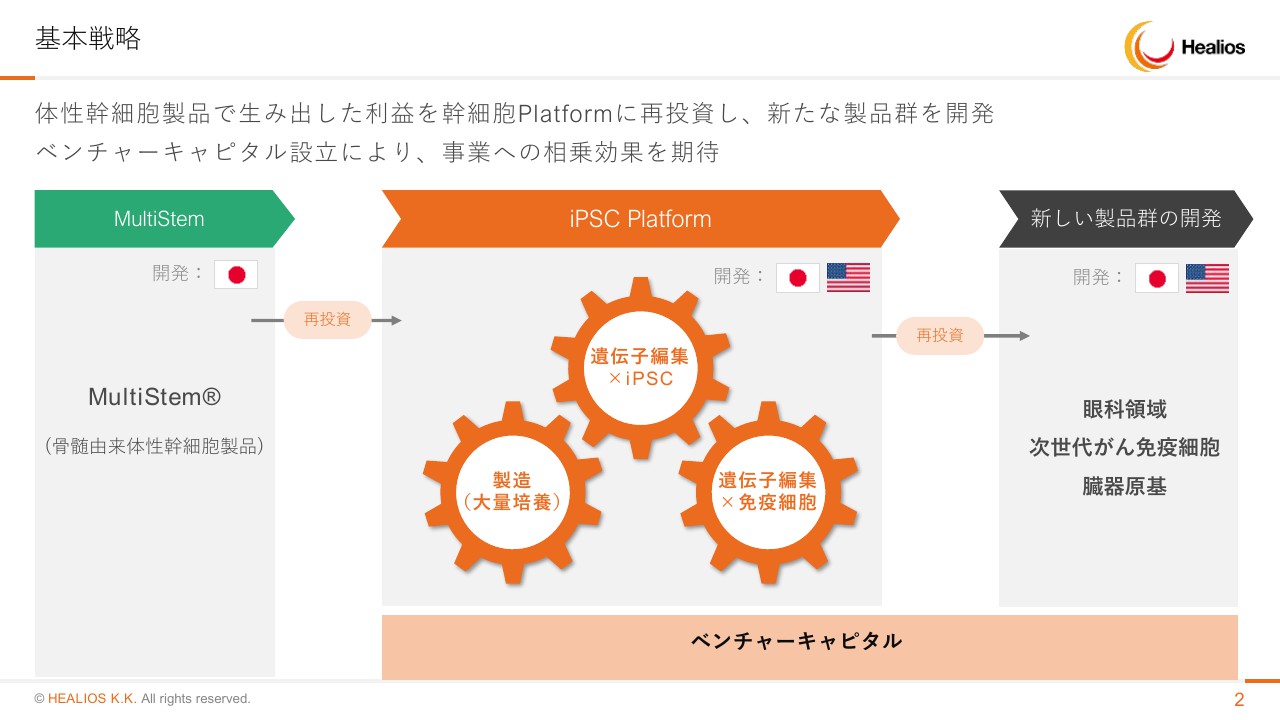
まず、基本戦略から始めます。従来ハイブリッドモデルと表現していますが、導入品である「MultiStem」の開発を進めて早期の黒字化、製品を出す体制を作っていきます。そのなかで、着実に進んでいるのが「iPSC Platform」でございます。
これは3つの大きな技術分野からなりますが、iPS細胞を遺伝子編集していく技術、遺伝子を編集された免疫細胞を作る技術、大量培養製造です。こちらのプラットフォーム技術でできてきた製品を、しっかりグローバルに出していく戦略を取っています。
また、昨年発表しましたとおり、ベンチャーキャピタルを作る予定でございます。こちらを作ることにより、日本のみならずグローバルに、今後さまざまなバイオテクノロジーが向かう方向と、我々が戦略的に取り組むべき技術や日本市場に適合した技術等々を見極めていき、将来の成長の源泉としたいという戦略を取っています。
iPSC Platform
「iPSC Platform」は先に申し上げました3つの技術領域からなりますが、とくにそのなかで重要なところの話を深掘りしたいと思っています。
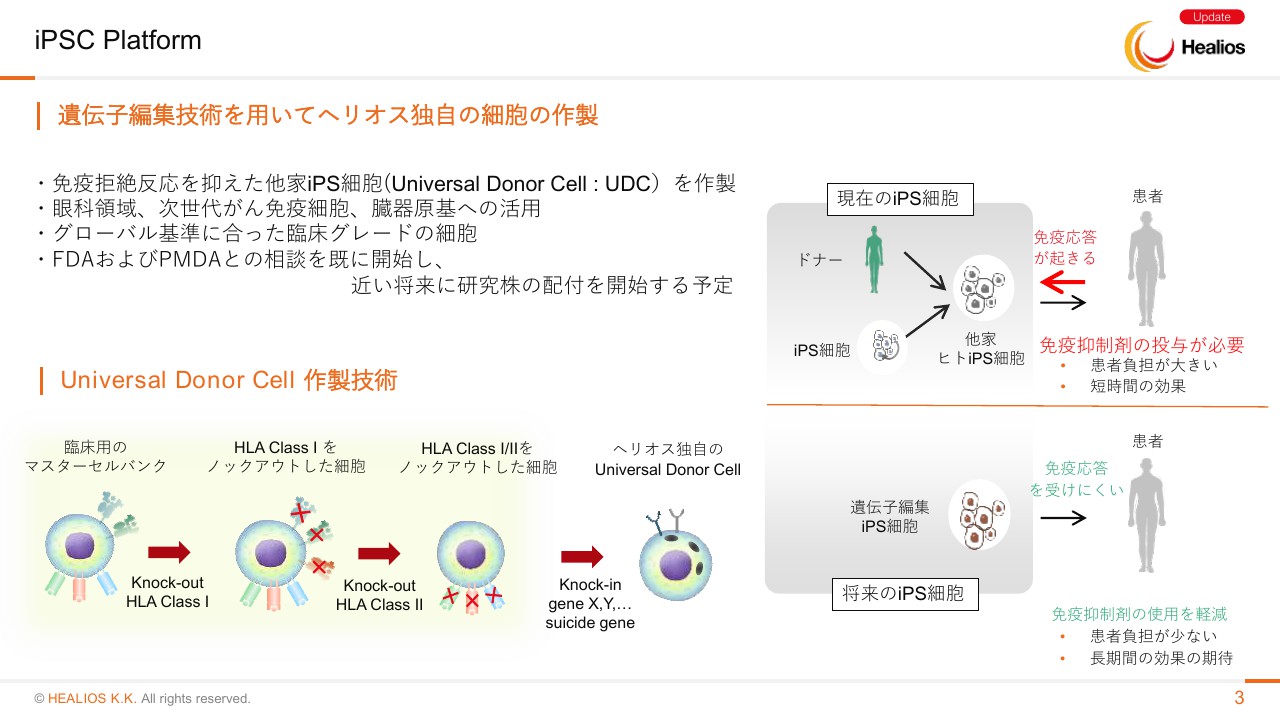
「遺伝子編集技術を用いてヘリオス独自の細胞の作製」と表現させていただきました。免疫拒絶反応を抑えた他家のiPS細胞(Universal Donor Cell)を作製中でございます。もう、ほぼできあがってきています。こちらは従来、臨床研究などですでに複数のiPS細胞由来の製品が、日本のアカデミアで患者さんに投与され始めていますが、HLAを合わせるものあるいは自家のアプローチでは限定的でございます。
その限定性を外すために必要なのが「Universal Donor Cell」です。すなわち、1つの細胞で免疫拒絶がなく世界中の方を治せる、といった細胞(の研究)を進めてきています。こちらの技術は眼科領域、「Immuno oncology」と言われる次世代のがん免疫細胞、今年いよいよ臨床研究の申請がなされる臓器原基への活用をしていきたいと考えています。
非常に重要なことでございますが、規制産業でございますので、「Universal Donor Cell」はグローバル基準に合った臨床グレードの細胞でなければなりません。現在は、このあたりをしっかり満たしたものを作っています。
すでにFDAおよびPMDAとの相談を開始しており、近い将来に研究株の配付を開始する予定でございます。そのなかから将来的に、当社のパイプラインとして提携になるものも出てくるでしょう。こういったプラットフォームを使った、レバレッジの効いたビジネスが立ち上がってきていると考えます。
「Universal Donor Cell」は、下に書いてあるとおりでございますが、もうすでに当社で確立していますが、日米欧3局の承認に値する要件を満たした細胞を、非常に早期から作って持っていました。こちらをはじめの細胞として遺伝子改変を行い、ヘリオス独自の「Universal Donor Cell」ができてきています。
患者さんが免疫抑制剤なく、理想としては1回の投与で何年も細胞が保たれ機能を続ける、というような、みなさんが再生医療という言葉を聞いたときにイメージされる再生を実現するための、ベースとなる技術と考えています。
HLCN061 iPS細胞由来遺伝子編集NK細胞の開発
「Immuno oncology」です。iPSC Platform技術になりますが、そこのお話をしたいと思います。我々のなかでは、そもそも再生医療を行うにあたって、iPS細胞の遺伝子を改変して「Universal Donor Cell」を作らなければならないというところから、会社のチームができてまいりました。
しかし、一度チームができてみますと、iPS細胞の分化誘導への知見ができ、今後の製品のバリエーションは無限に広がるわけです。ターゲットとなるがんについて、どの遺伝子をブーストするかあるいは下げるか……、さまざまな組み合わせによって、あるがん種にもっとも効き具合のよいものができます。
例えば従来の低分子や抗体薬であれば、毎回ものが変わる毎にリスクが違うわけです。しかし、もともとのiPS細胞は我々が持っていますし、安全性もわかっています。その中の遺伝子を変えることによって、さまざまな戦略を取ることができます。
これは言ってみれば、ITのソフトウェアの世界でコードを書き直す技術に近いものです。今、欧米では遺伝子治療が非常に盛んでございますが、同じように遺伝子治療を細胞と合わせることによって、これまでなかった治療が広がってきていると思っています。
その具体的な1歩目が「Immuno oncology」であり、NK(Natural Killer)細胞であると書いています。
この細胞の領域においては、すでに「CAR‐T」と言われるTセルを用いた免疫がんの療法があり、非常に高い治療成績を示しています。しかし、まだ固形がんや他家での治療ができておりません。我々はそこに向かっていっています。
いわゆる自然免疫と言われるNatural Killer細胞ですので、非常にブロードな効き方をします。さまざまな対象のがんに効き、かつ遺伝子編集をすることによって、体の中のNK細胞では得られない能力を持った、特殊にトレーニングされた細胞を作り、がんを殺す能力を極限まで高めた細胞ができると考えています。
HLCN061 iPS細胞由来遺伝子編集NK細胞の開発
(スライドを指して)このような流れでこの業界は進化しています。第1世代が自家の細胞、末梢血系由来でございました。第2世代が他家細胞、iPSストックと言われるものです。こちらの臨床研究はさまざまに行われています。
第3世代の「Universal Donor Cell」から遺伝子改変が入ってきますので、バリエーションが無限になってきました。例えばがん細胞やさまざまな他の組織を置き換えるにあたって、好きなようにデザインが可能な世界に入ってきました。
繰り返しになりますが、ITの世界でコーディングを自由にやって、さまざまなプログラムができてきた……、この細胞・遺伝子編集・改変の世界は、そういう時代の黎明期にあると認識しています。
開発パイプラインの進捗
基盤技術の説明でございます。開発パイプラインのおさらいをしたいと思っています。
体性幹細胞領域は今年、非常に大きなイベントが2つございます。脳梗塞、急性呼吸窮迫症候群で、いずれもデータによりますが、脳梗塞は第Ⅱ・Ⅲ相試験、急性呼吸窮迫症候群はフェーズ2で30例オーファン指定を取っていますので、データによってはこのまま承認に行けるのではなかろうかと期待しています。こちらのデータが、少なくとも今年中には患者さんの組み込みが終わるということです。
「iPSC Platform」も充実してきまして、WetタイプAMDは、すでに発表させていただいたとおり、大日本住友製薬さまが主体になって治験を計画していらっしゃいます。
代謝性肝疾患は、いよいよ今年、臨床研究の申請がなされますので、ヒトへのPoCに向けて着実な一歩を踏み出すことになります。
固形がんは日本に限らずグローバルで進めていくことになります。NK細胞の編集もできてきていますので、臨床試験開始の時期などは、後々発表させていただきたいと思っています。
また、グローバルの眼科の領域に関しましてはさまざまな技術が出ていますので、現在どの細胞種でどのように世界に攻めていくかは検討中でございます。こちらも戦略が固まり次第、「iPSC Platform」の戦略として発表させていただきたいと思っています。
HLCM051 Stroke 治験概況
それでは、今年の大きなカタリストとなると期待されている、STROKEとARDSの説明に入りたいと思います。
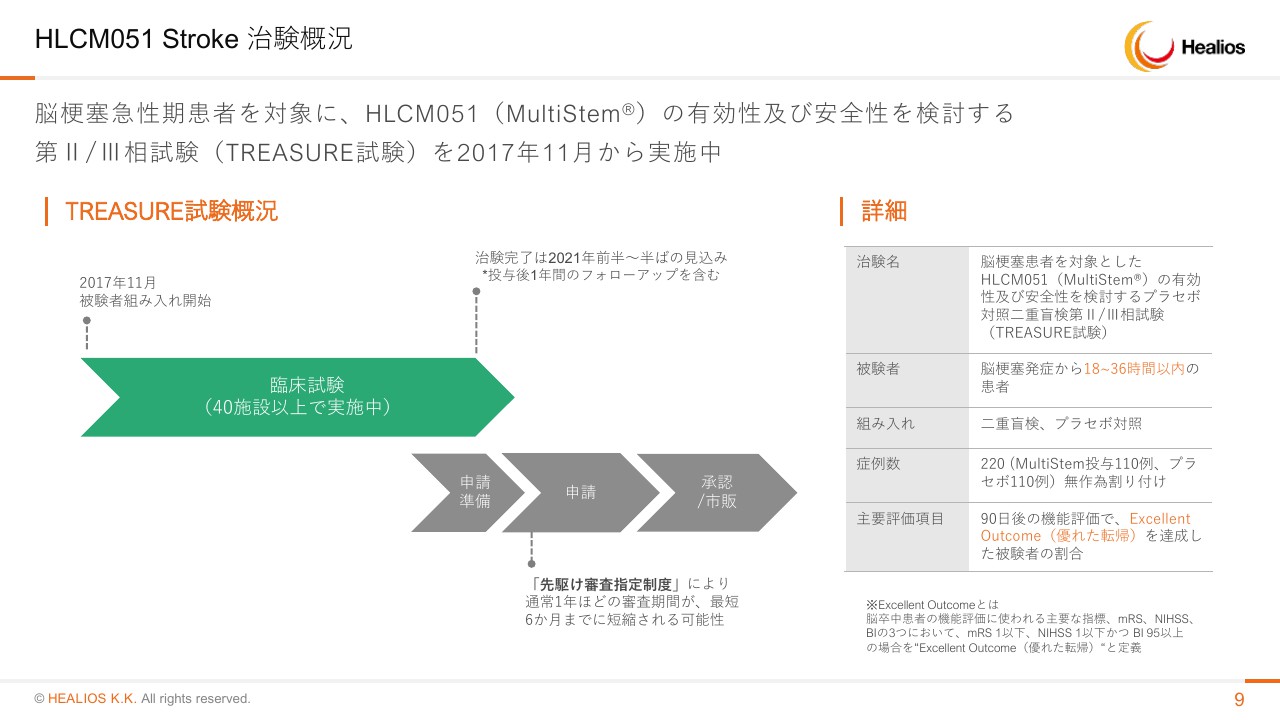
STROKEは第Ⅱ・Ⅲ相試験220例、Double Blinded Study(二重盲検試験)は、先駆け指定をいただいています。脳梗塞発症から18時間から36時間の患者さんを対象にしているところでございます。エンドポイントはExcellent Outcomeです。
アサシス社による二重盲検試験結果 <脳梗塞急性期>
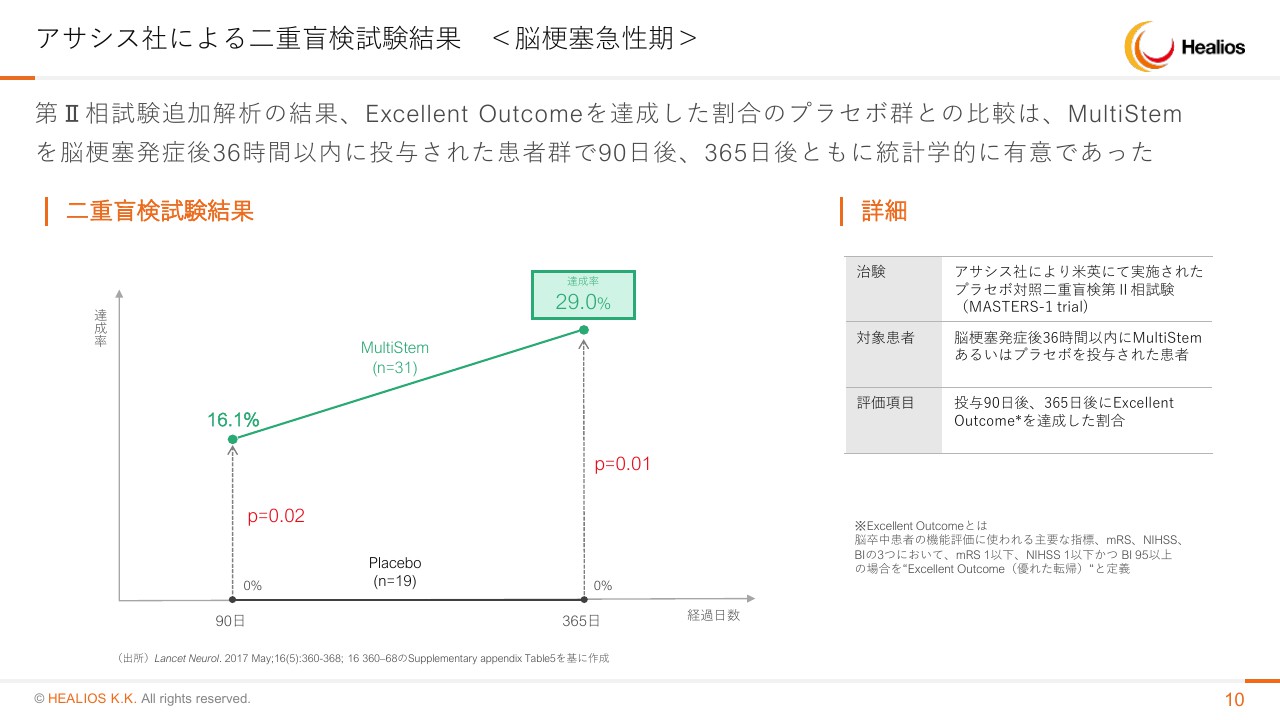
こちらは順調に進捗しています。二次解析ではございますが。過去のデータを見ましても、Excellent Outcomeをエンドポイントと置いた場合、90日の時点において16.1パーセントの方がエンドポイントを満たし、1年後には29.0パーセントの方が達成するという結果が出ています。
p-valueも非常に強く、220例まで症例を上げていますから、非常に安定したかたちでこのような再現性が得られるではないかと期待しています。
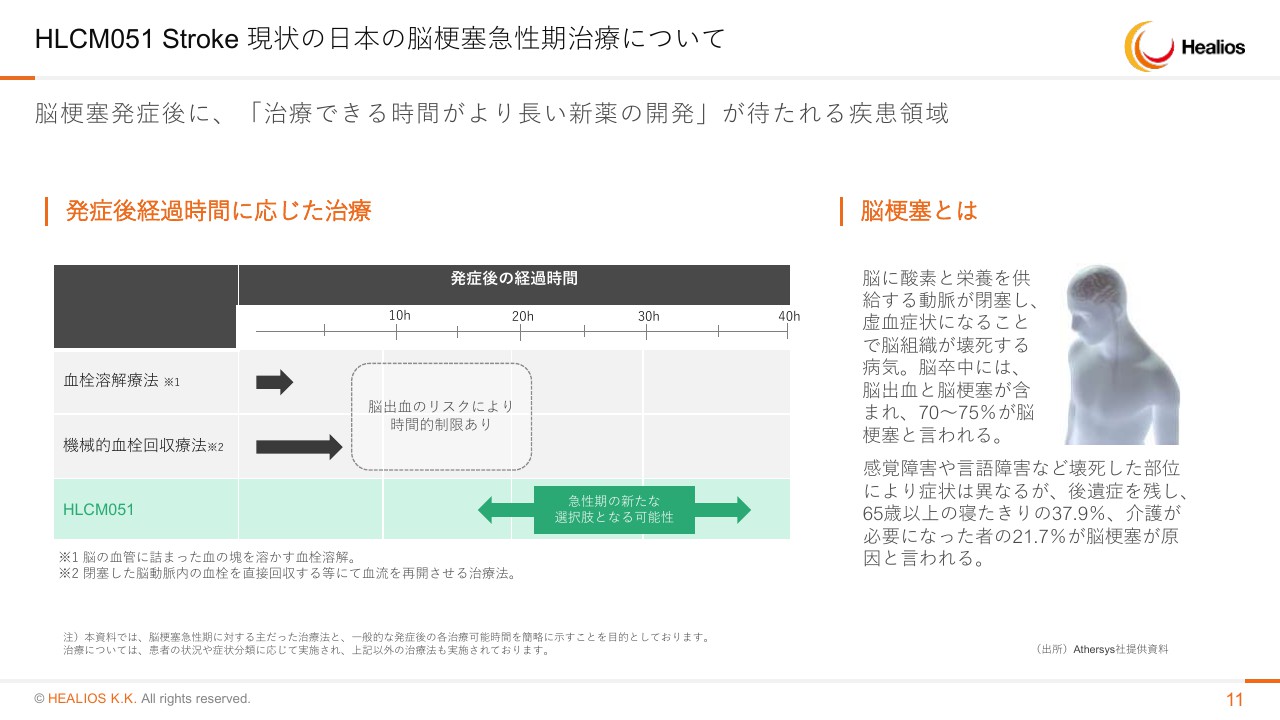
HLCM051 Stroke 現状の日本の脳梗塞急性期治療について
18時間から36時間になりますので、この時間に提供されている現在の治療法はございません。ですので、この製品の商品化後は、非常に広くこの時間帯で使われる製品になるのではなかろうかと思っています。
細胞での競合製品もいくつか出てきていますが、開発タイムラインでは我々がもっとも先行しており、治療の時間軸でも、我々が知る限りは一番早い時間に我々が投与することになりますので、マーケットでもしっかり使われていくと考えています。
HLCM051 Stroke 脳梗塞の年間発症患者数
脳梗塞の患者さん自体は非常に多く23万人から33万人、重篤な患者さんは約13万人です。そのなかでさらに、現在治験を行っている36時間以内に限定しますと、6万2,000人の方が対象になります。これがマーケットでございます。
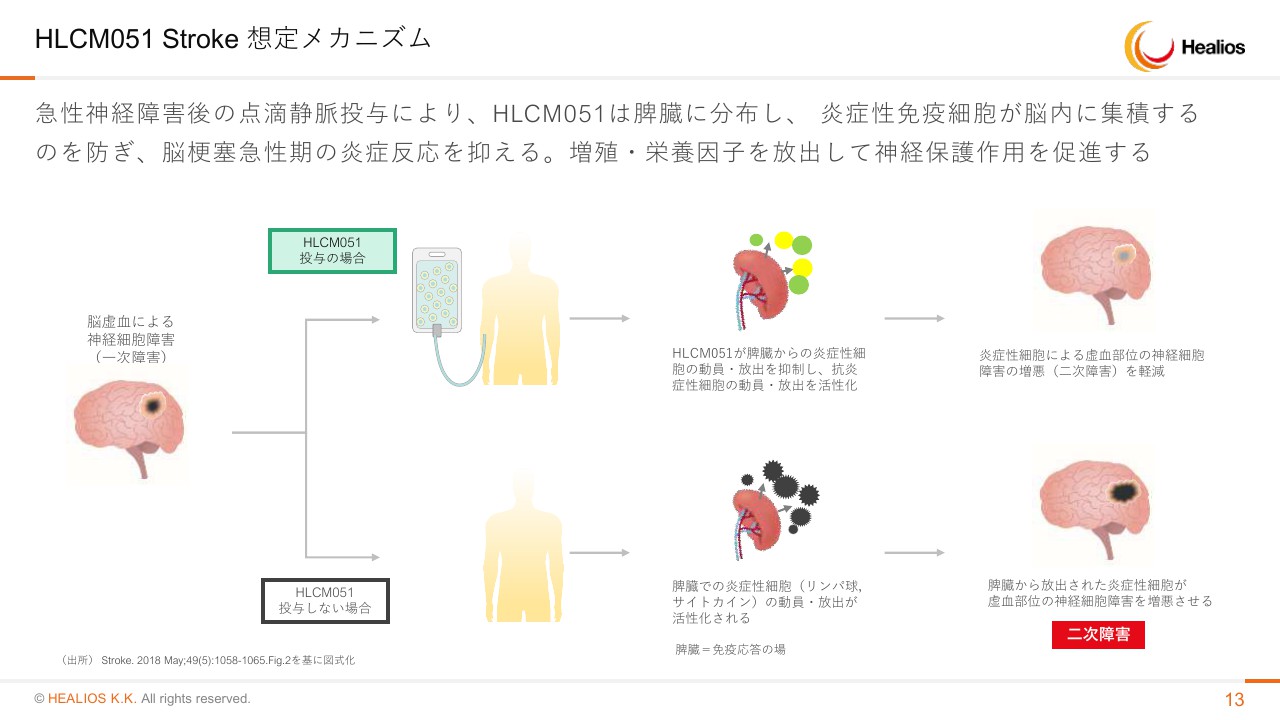
HLCM051 Stroke 想定メカニズム
メカニズムです。「MultiStem」は骨髄由来の、血液になる大元の細胞のような細胞でございます。特徴としては、血中の炎症性サイトカインをしっかり抑えていくところでございます。
脳梗塞は血管が詰まる病気ですが、詰まった後に血流が行かない細胞が死ぬ一次損傷はそのまま起こります。我々が想定している薬理作用は、その後に死んだ細胞がサイトカインを出して、免疫細胞を呼んできて周りをところ構わず攻撃します。これで災害がどんどん広がるんですが、この二次損傷を抑えることです。
HLCM051 ARDS 治験概況
ARDSは、肺炎を原因疾患とするARDS患者を対象に、「MultiStem」の有効性および安全性を検討する第Ⅱ相試験(ONE-BRIDGE試験)を、2019年4月より実施しています。昨年11月25日に、希少疾病用再生医療等製品(オーファン)指定を受けました。こちらは30例で、オープン試験が20例の投与群、標準治療群が10例入っています。
投与後28日間のうち、人工呼吸器を投与しなかった日数を見るところをエンドポイントに置いています。
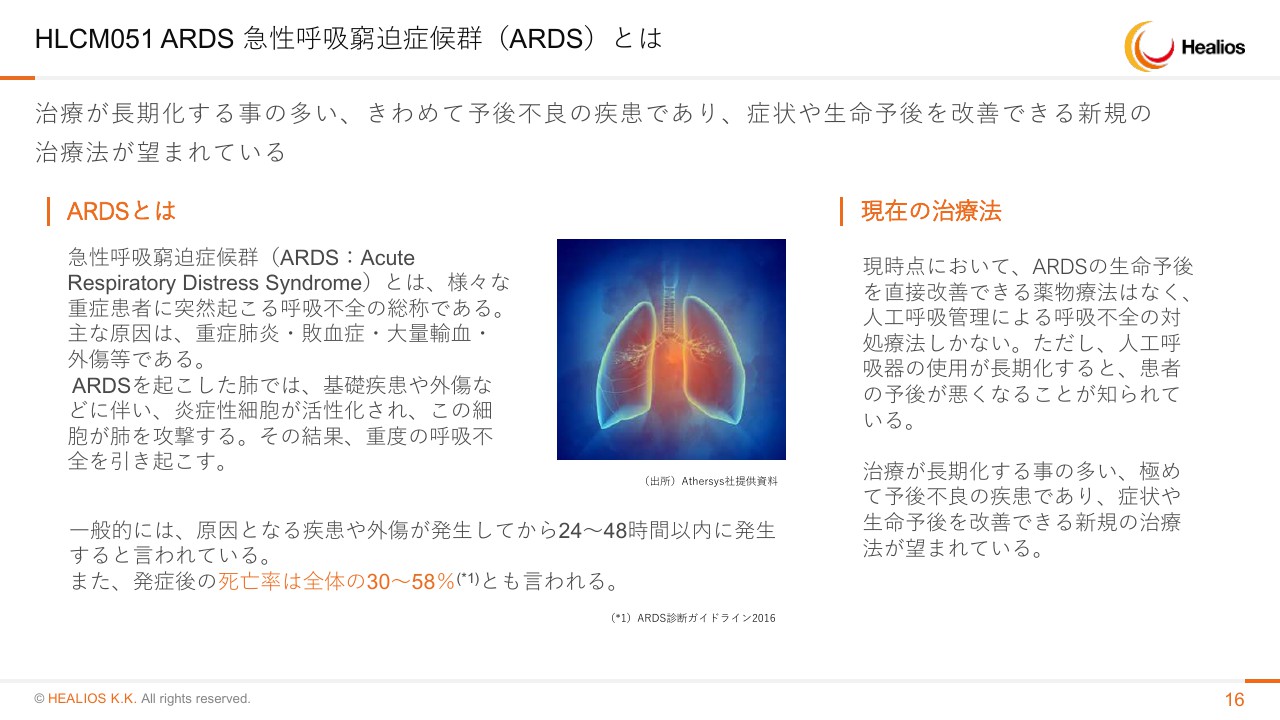
HLCM051 ARDS 急性呼吸窮迫症候群(ARDS)とは
ARDSという病気は、日本語で急性呼吸窮迫症候群ということで、なかなか馴染みがない名前であろうかと思います。私も臨床経験は短く、(もともと)眼科にいたんですが、眼科でこの病名を聞くことはないぐらい、なかなか聞かないものでした。しかし、昨今のコロナウイルスのこともあり、急にこの疾患の理解が世の中で進んでいる感じでございます。
まずどういう病気かですが、原因はいろいろあるんです。さまざまな重症疾患で起こる呼吸不全を総称しています。主な原因は重症肺炎・敗血症・大量輸血・外傷など、さまざまなことで起きます。
もともとこの病気が見つかったのは、ベトナム戦争の時なんです。ベトナムにダナンというところがありますが、ベトナム戦争の時にそこに運ばれてくる米軍の兵士がなぜかみんな肺炎になるんです。足を撃たれた、腕を撃たれた、感染症だ、なぜか肺炎になる……、当初はダナン肺炎と呼ばれていました。
後にわかったのは、体のどこかで炎症が起きるとそれが肺に詰まるんです。肺は体の中でもっとも細やかな毛細血管があるところです。私は今コーヒーを飲んでいますが、コーヒーのフィルターみたいなところです。
体中でできたサイトカインが肺に溜まってしまうと、我々の免疫システムはそこで炎症が起こっている、ばい菌が入っていると勘違いしてしまうんです。そこでみんな免疫細胞は肺に行って肺を攻撃します。これは必要のない攻撃です。しかし、我々の免疫システムがそう作られているので、しょうがないです。これがARDSです。
自分の免疫の必要のない攻撃によって肺がめちゃくちゃに攻撃されて、水浸しになって、最後には水に溺れたように呼吸がどんどんできなくなって亡くなる病気です。重症例では、全体の30パーセントから58パーセントの方が亡くなります。ほぼ半分ぐらいの方が亡くなる病気です。
現在の治療法は、簡単に言うとありません。人工呼吸器を付ける、ステロイドを使うとかいう程度で、対症療法しかないです。いったんなると、もうどうしようもないという状況でございます。ウイルスの感染って、死ぬ直前の病態は多くがARDSです。ここを止められるかどうかが、一番最後の戦いであるということでございます。
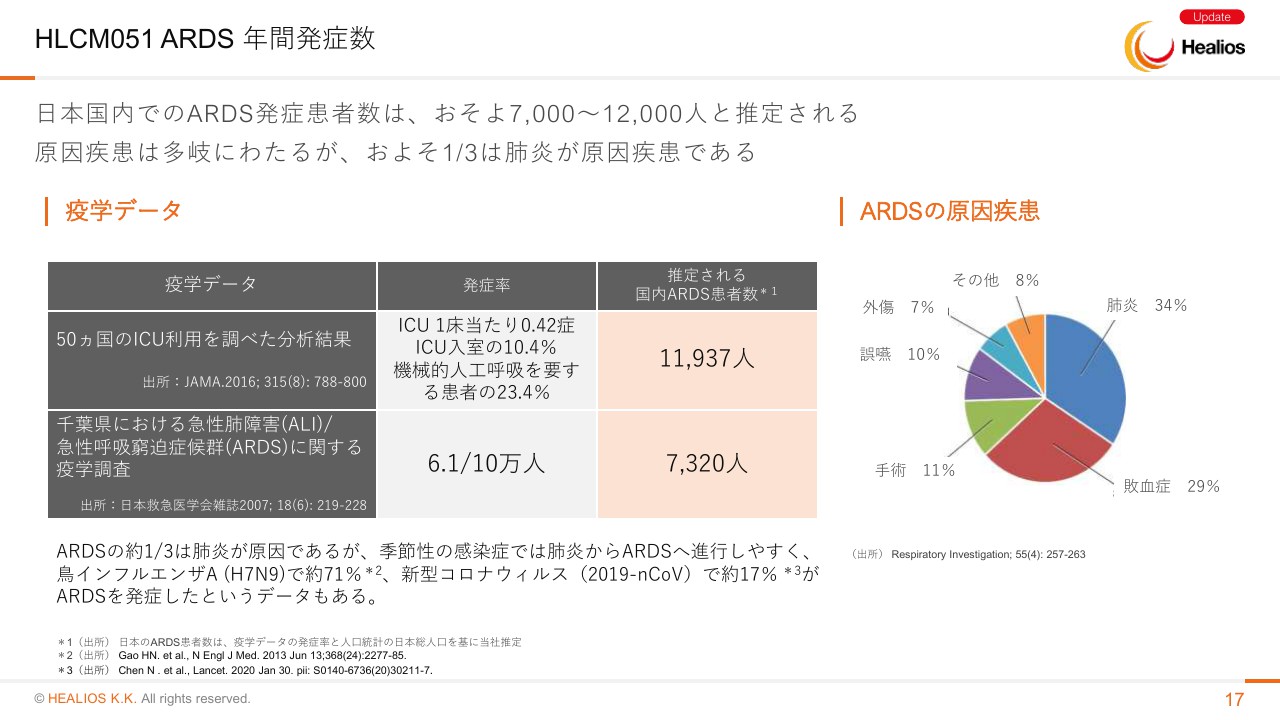
HLCM051 ARDS 年間発症数
定常状態では、日本国内での発症は約7,000人から1万2,000人ぐらいで、だいたい1万人ぐらいとイメージしていただければと思います。この増減は、インフルエンザとかコロナウイルス、鳥インフルエンザといったもので増えるなどはあります。
(スライドの)右にグラフがありますが、ARDSの原因疾患は、肺炎が3分の1ぐらい、敗血症が3分の1ぐらいで、あとは手術や誤嚥など、いろいろあるという状況でございます。
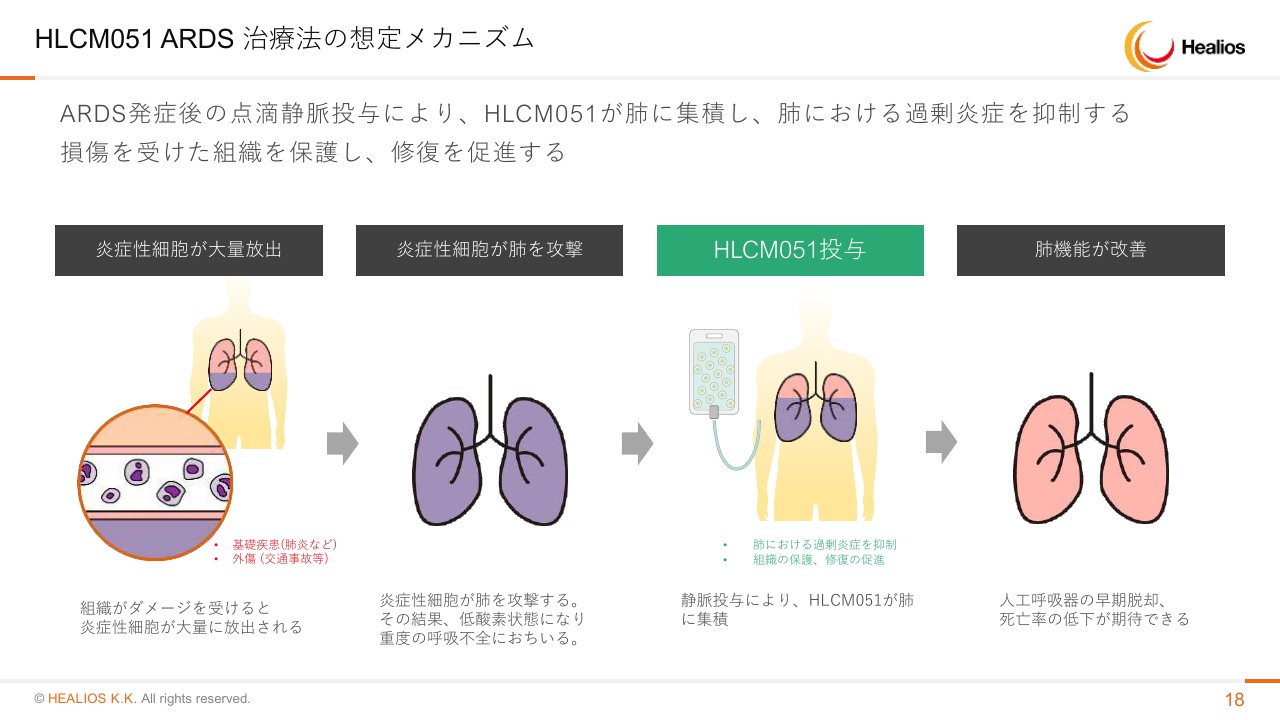
HLCM051 ARDS 治療法の想定メカニズム
想定メカニズムは脳梗塞と一緒です。血中のサイトカインを抑えるという非常にわかりやすいものでございます。これは過去の繰り返しになりますが、ヒトへの投与の結果、血中のサイトカインがことごとく下がっているものは確認されていますので、このメカニズムは十分あてになるであろうと(思います)。
問題は、このARDSという病気は原因疾患がさまざまあり、重さもバラバラですので、そういった患者さんに対してしっかり命を救えるかどうかというところです。あるいは、エンドポイントであるVentilator-Free Days、人工呼吸器を付けない日数できっちり数に差が出るかがこの治験の勝負どころでございます。
アサシス社による二重盲検試験結果 <ARDS>
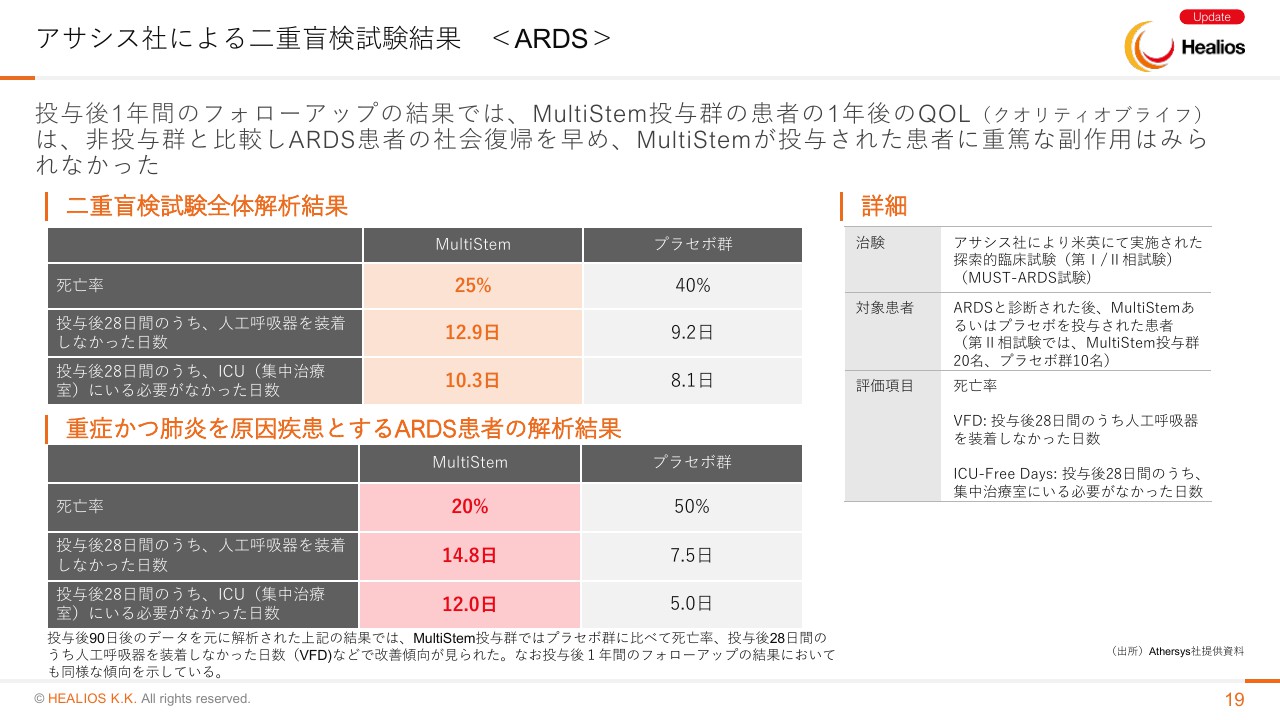
過去の結果を見ますと、アサシス社による二重盲検試験が行われています。投与後1年間のフォローアップでは、投与群の患者さんのQOLと表現していますが、非投与群と比較し、ARDSの患者さんで社会復帰を早め、「MultiStem」が投与された患者さんに重篤な副作用は見られなかったことが、最近発表されています。
先のデータをお示しします。デザインどおり二重盲検を行って、その結果がポジティブであったことになります。あらためて説明させていただきますが、二重盲検試験を行った結果、こちらも30例の患者さんに投与して、10例のプラセボ群で20例が投与群です。死亡率に大きな差があり、プラセボ群では死亡率が40パーセント、「MultiStem」投与群は25パーセントです。
我々がエンドポイントにしています、人工呼吸器を装着しなかった日数が28日のうちどれくらいあるかですが、「MultiStem」が12.9日、プラセボ群が9.2日でした。この3日の差がなかなか大きいわけです。3日の差が、死亡率のほぼ15パーセントぐらいの差に寄与しているということでございます。
我々が今、実際に治験をしている患者さんに限るとどうだったのかということになりますが、肺炎を原因とするARDSの患者さんを分析しますと、プラセボ群が死亡率50パーセントに対して、「MultiStem」の投与群は20パーセントです。ですので、約3割ぐらいの方の命を助けることができています。
下の人工呼吸器を外せた日数ですが、プラセボ群が7.5日で、投与群が14.8日でございます。その下の、ICUにいる必要がなかった日数ですが、プラセボ群が5日に対して「MultiStem」が12日と、大きな差があります。もし同じような有効性が出るのであれば、ICUから出られる日数は約7日ぐらいです。1週間早く「MultiStem」が治せて退院でき、死亡率は3割ぐらい差が出ることが期待できるのではなかろうかと考えています。
ここは現在、治験を行っている途中でございますので、どのような結果になるかはまたそのデータを見て、ということになります。
正式な会社としての治験終了時期は公開している状況でございますが、今年はインフルエンザの流行り具合が予想より大きくございまして、少し時期が早まる可能性が出てきていると思っています。ただ、まだ可能性でございますので、正式にはもう少し患者さんの数を見極めたうえで、時間軸を変更する場合には、あらためて正式に開示させていただきたいと思っています。
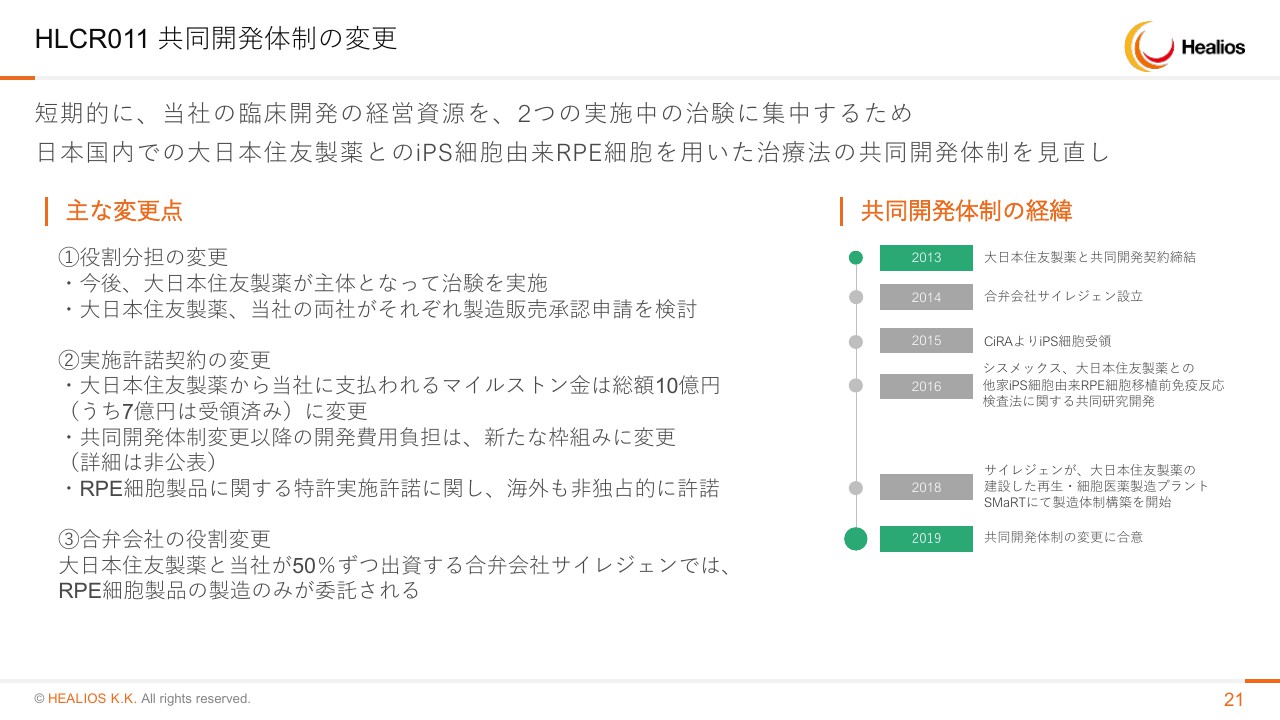
HLCR011 共同開発体制の変更
「iPSC-RPE」に入りたいと思います。こちらはすでに発表してありますとおり、現在は大日本住友製薬さまが主体で開発を進めていますので、そちらの進捗を待っている状態でございます。当社と大日本住友製薬さまが50パーセントずつ出資するサイレジェンで、RPE製品の製造を続けているところでございます。
HLCR011 AMD 病態説明
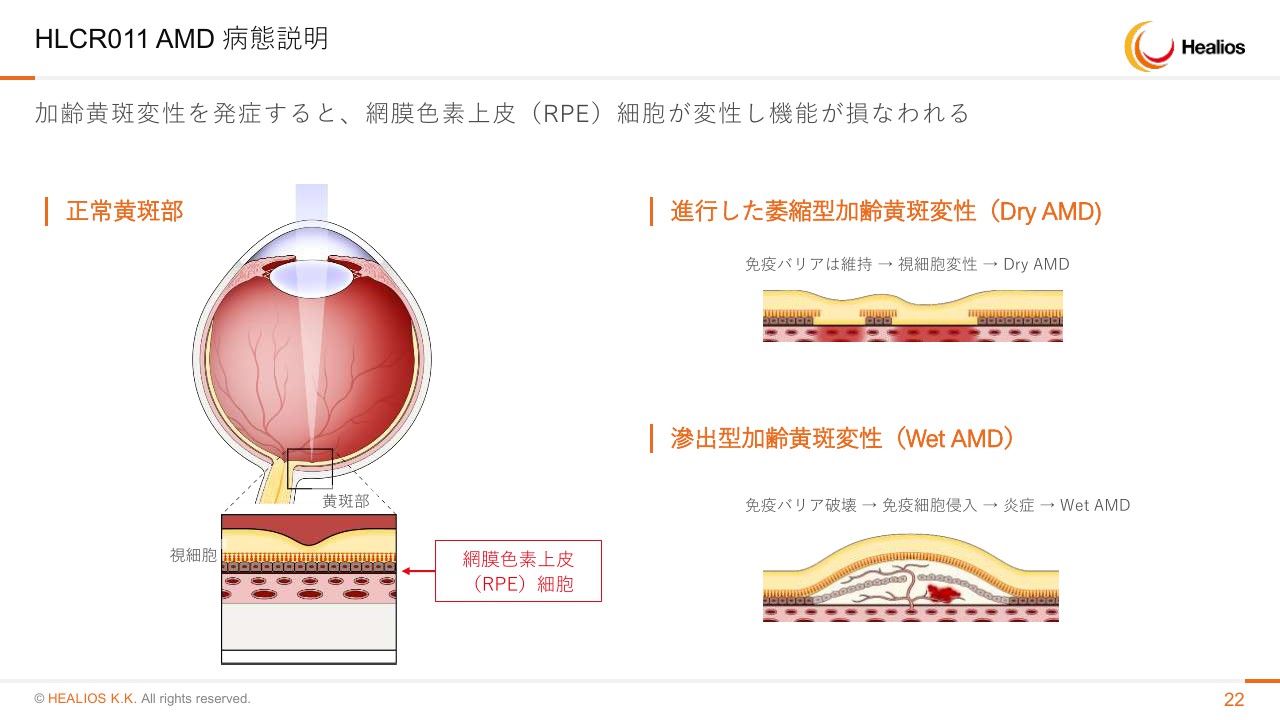
加齢黄斑変性は、RPE細胞が駄目になって起こる病気であります。
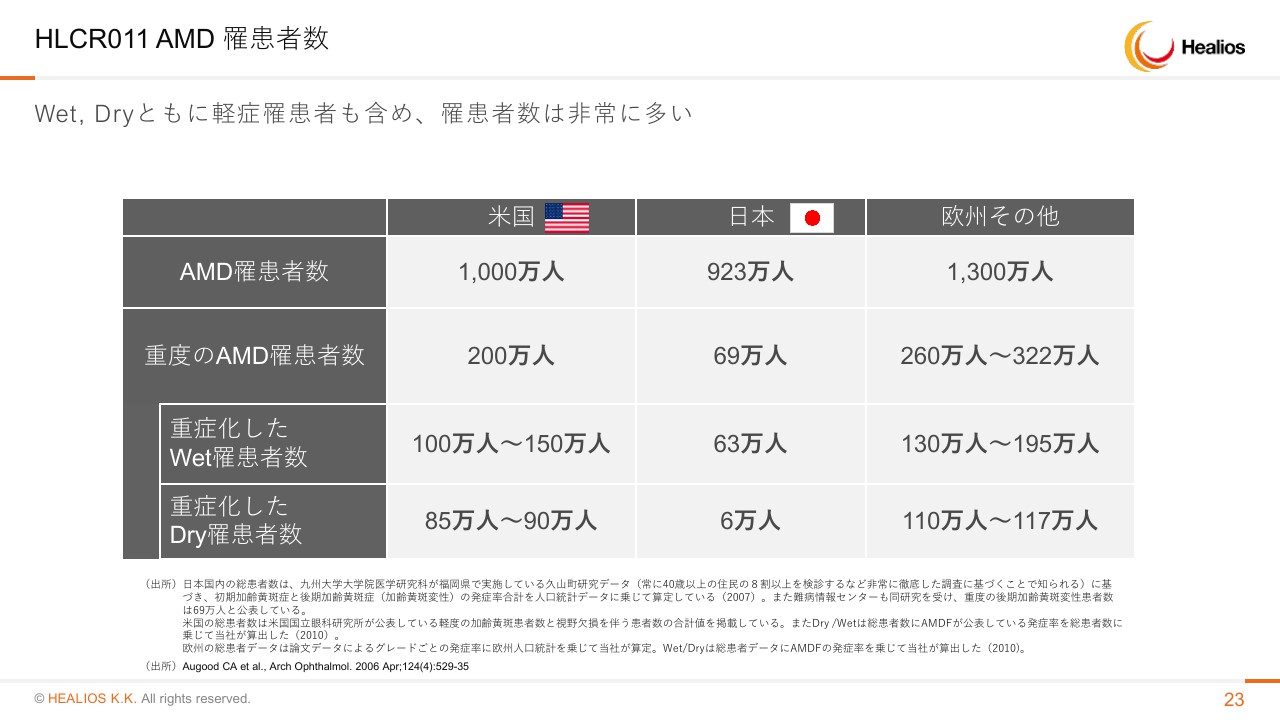
HLCR011 AMD 罹患者数
患者さんの数は非常に多いです。
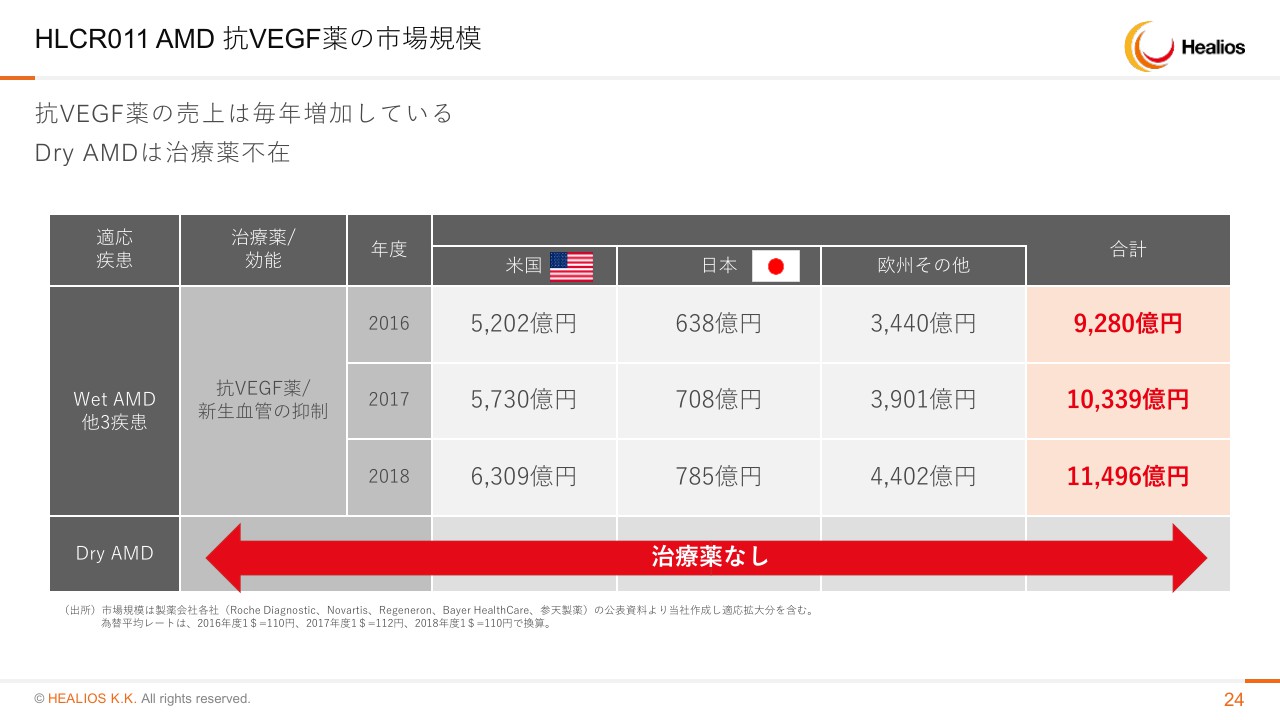
HLCR011 AMD 抗VEGF薬の市場規模
市場は年々大きくなっており、ざっくり言って、グローバルで年間1,000億円ずつ市場規模が拡大していっています。Dry AMDはさらに患者さんの数は多いですが、治療薬はない状況でございます。
先に少し述べさせていただきましたが、会社としては、RPEの次に結局これでDry AMDなど、眼科に残る本当のアンメット・メディカル・ニーズを治せるのかどうか、といったことを考えながら、次の手を打っているところでございます。
こちらも「iPSC Platform」から出せるときには、正式に会社として決めたうえで発表していきたいと思いますが、いずれにせよ「Universal Donor Cell」をはじめとした次世代の細胞を用いたものになりますし、そこからの戦略はリセットされて新たなスタートになると考えています。
HLCR011 AMD RPE細胞製品の製造体制
製造体制はサイレジェンでしっかり持っており、製造を着々と進めています。当社としても、iPSC‐RPE製品を作ることによって、実際にiPSCを用いた製品の製造と、治験開始まで持っていくノウハウが当社に付いたことは非常に大きいと考えています。これは今後、我々が「iPSC Platform」を世に出していくにあたって、何ものにも代えがたいノウハウではなかろうかと考えています。
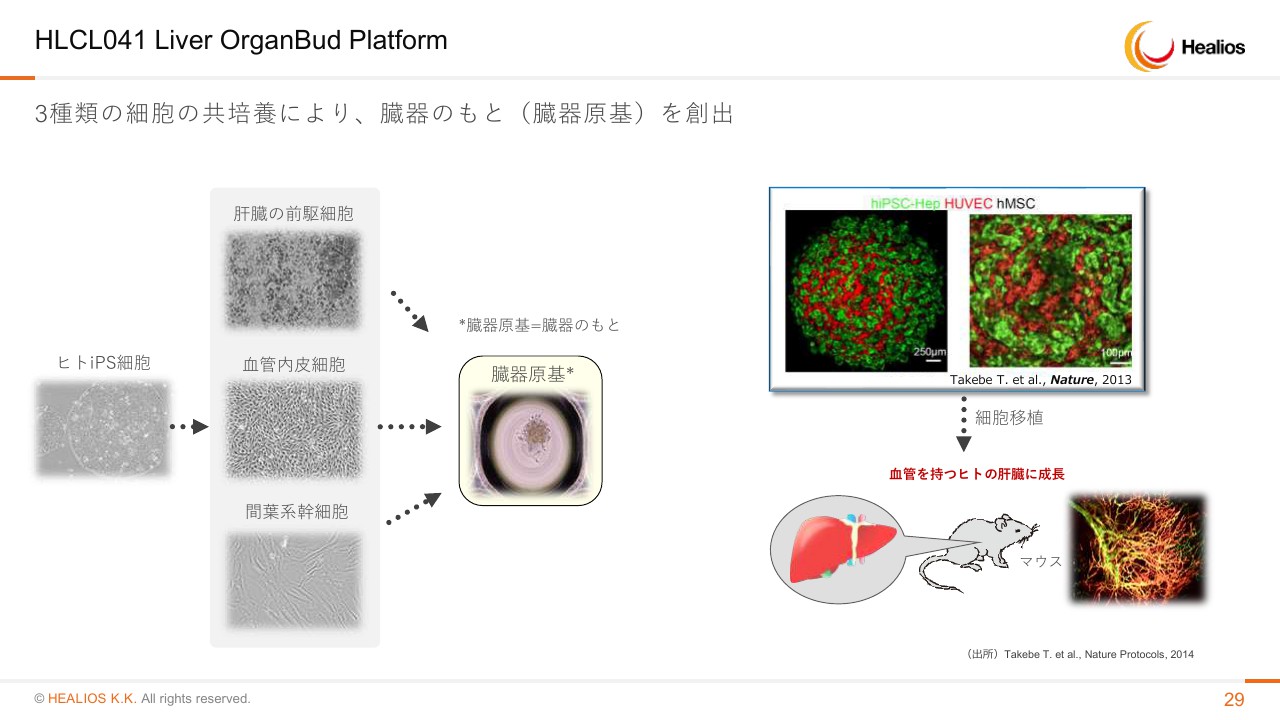
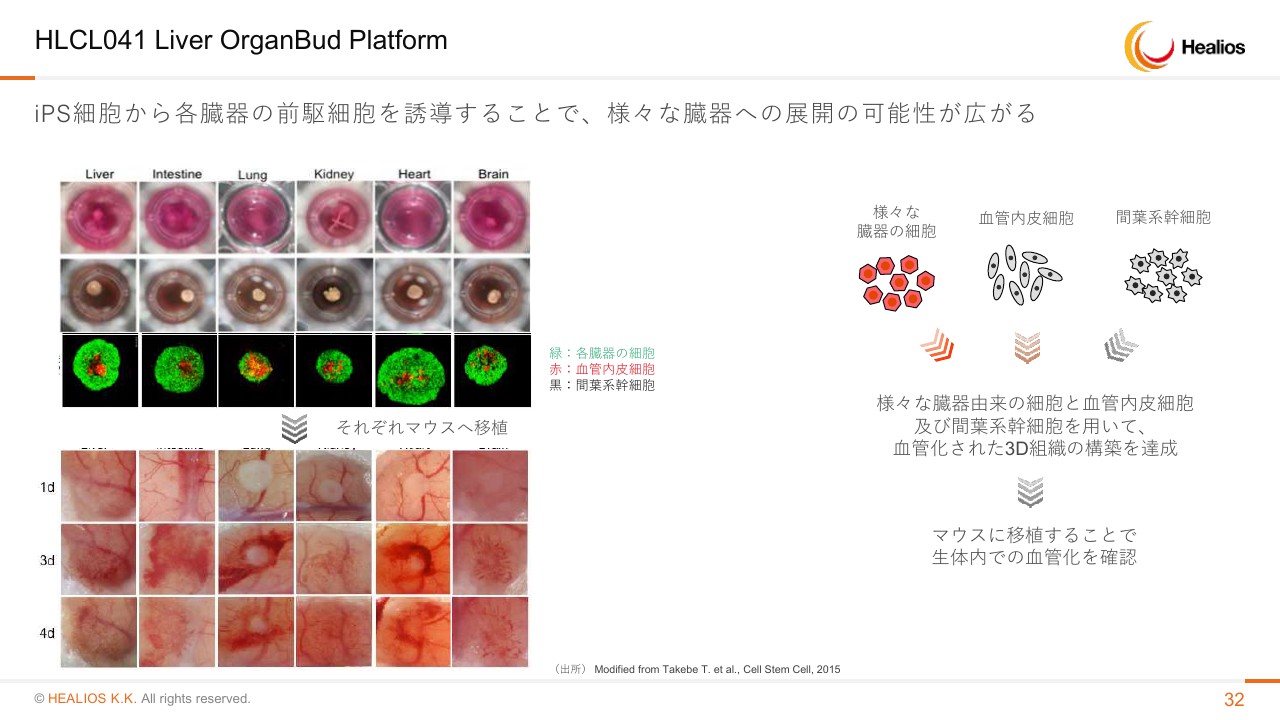
HLCL041 Liver OrganBud Platform
肝臓も非常に革新的な技術で、我々が従来、世界での独占的な権利を持って研究開発を進めているものでございます。どういった技術か簡単におさらいをしますと、今は部屋に80人ぐらいいらっしゃると思うんですが、我々には普通に肝臓があり、お母さんが「いつどう作れ」なんて言っていないわけです。自然に1個の受精卵から肝臓が、再現性よくできています。そのときに使われる仕組みを、谷口先生・武部先生が新たな方法で発明された、という技術になります。
簡単に言いますと、iPS細胞から肝臓のもとになる前駆細胞・血管内皮細胞・間葉系幹細胞の3種類をある一定の割合で混ぜると、臓器のもとになる卵みたいな芽ができるんです。
これを動物あるいはヒトに植えることによって、まるでお母さんの中で肝臓を作り出した瞬間に起こったような現象が起きます。細胞が周りの血管と結びつき、自らを肝臓として成長させ、血流に乗って血中に分泌していく、といったものがわかっています。
これを用いて、生まれつき肝臓のある1種類の酵素がなく生まれてくる方に投与し、治していきたいと考えています。
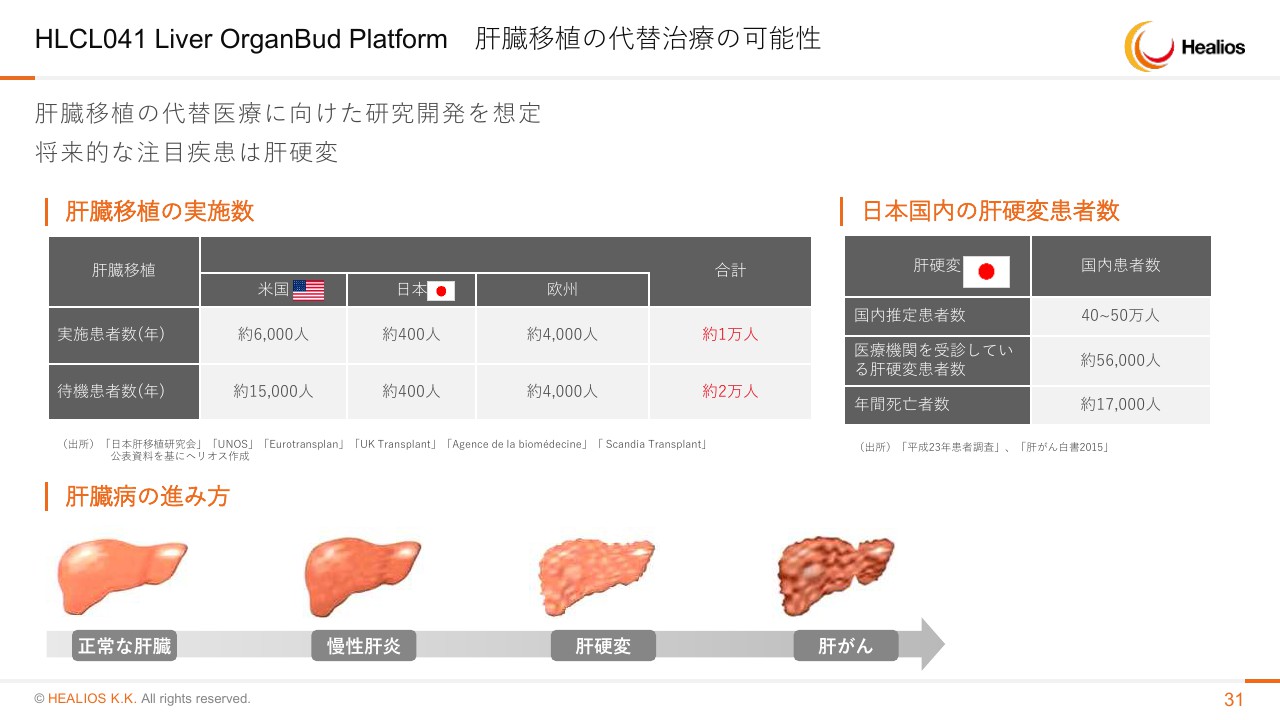
HLCL041 Liver OrganBud Platform 肝臓移植の代替治療の可能性
この肝臓の領域においてはさまざまな動きがあります。まず、我々の「Universal Donor Cell」ができてくること、PoCは、この先天性酵素異常の患者さんに治療していきますが、ゆくゆくはもっと大きな肝臓病、肝硬変や肝がんといったところに対する治療法を提供していきたいと考えています。
最終的には、臓器移植をなくしたい、臓器移植で待つ方を救っていきたいというところまで大きなビジョンがあります。こちらに関しては着実に、一歩一歩進んでいっていると思っています。
また、臓器原基自体も第1世代から第2世代、第3世代と、さまざまな機能が改善してきていますので、これはしっかり我々のなかでインキュベートしていきながら、治療法につなげていきたいと考えています。
HLCL041 Liver OrganBud Platform
基盤技術でございますので、肝臓に限らず腸や肺・腎臓・心臓・脳など、さまざまな組織を臓器化して生着させることができます。これは今後、我々が「iPSC Platform」として「Universal Donor Cell」を使うにあたって、本当の再生医療を実現するために非常に重要な技術となると考えています。
損益計算書(P/L)の概要
決算概況に入りたいと思います。当期利益は44億1,000万円の赤字となっています。昨年の同時期と比べますと、約10億円の研究開発費の減少がありますが、これはアサシス社との提携拡大のコストが、一昨年と昨年を比べていなかったということで、その分が減少しています。内訳の治験はしっかり進んでいますので、そちらは心配ございません。
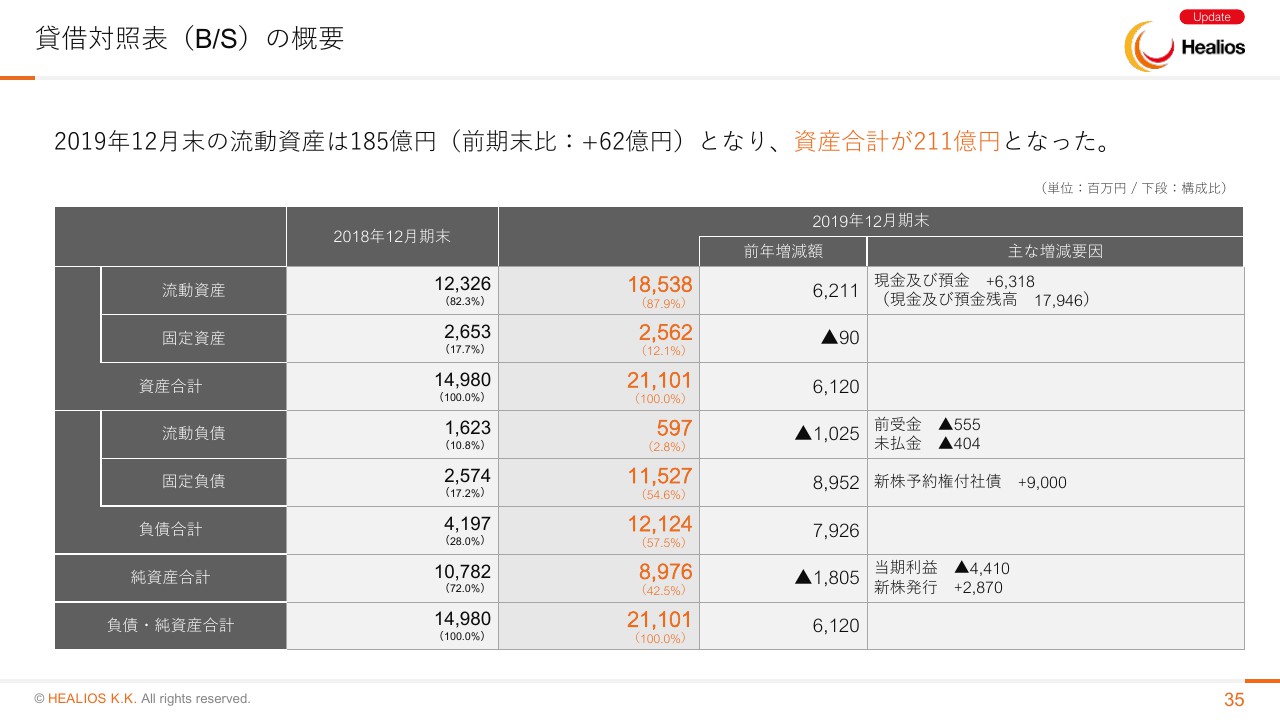
貸借対照表(B/S)の概要
B/Sですが、昨年末のキャッシュポジションは185億3,800万円でございます。現預金のポジションとしてはしっかりあります。今期はだいたい四半期ごとに、10億円から15億円程度の支出と見ていますので、十分キャッシュポジションが貯まったまま、2つのカタリストであるARDS・脳梗塞の結果を見届け、次の経営方針を決めていきたいと考えています。
以上、簡単でございますが、ヘリオス社の昨年2019年の決算をお話しさせていただきました。ご清聴ありがとうございました。