2019年11月25日に行われた、田辺三菱製薬株式会社2020年3月期第2四半期決算説明会の内容を書き起こしでお伝えします。IR資料
スピーカー:田辺三菱製薬株式会社 取締役常務執行役員 経理財務部担当 田原永三 氏
2019年度第2四半期 決算概要
田原永三氏:本日はご多用のなか、田辺三菱製薬株式会社の2019年度第2四半期決算説明会にご参加いただき、誠にありがとうございます。私は取締役常務執行役員の田原永三でございます。本日は決算概要、通期業績予想、研究開発の状況、株主還元についてご説明します。
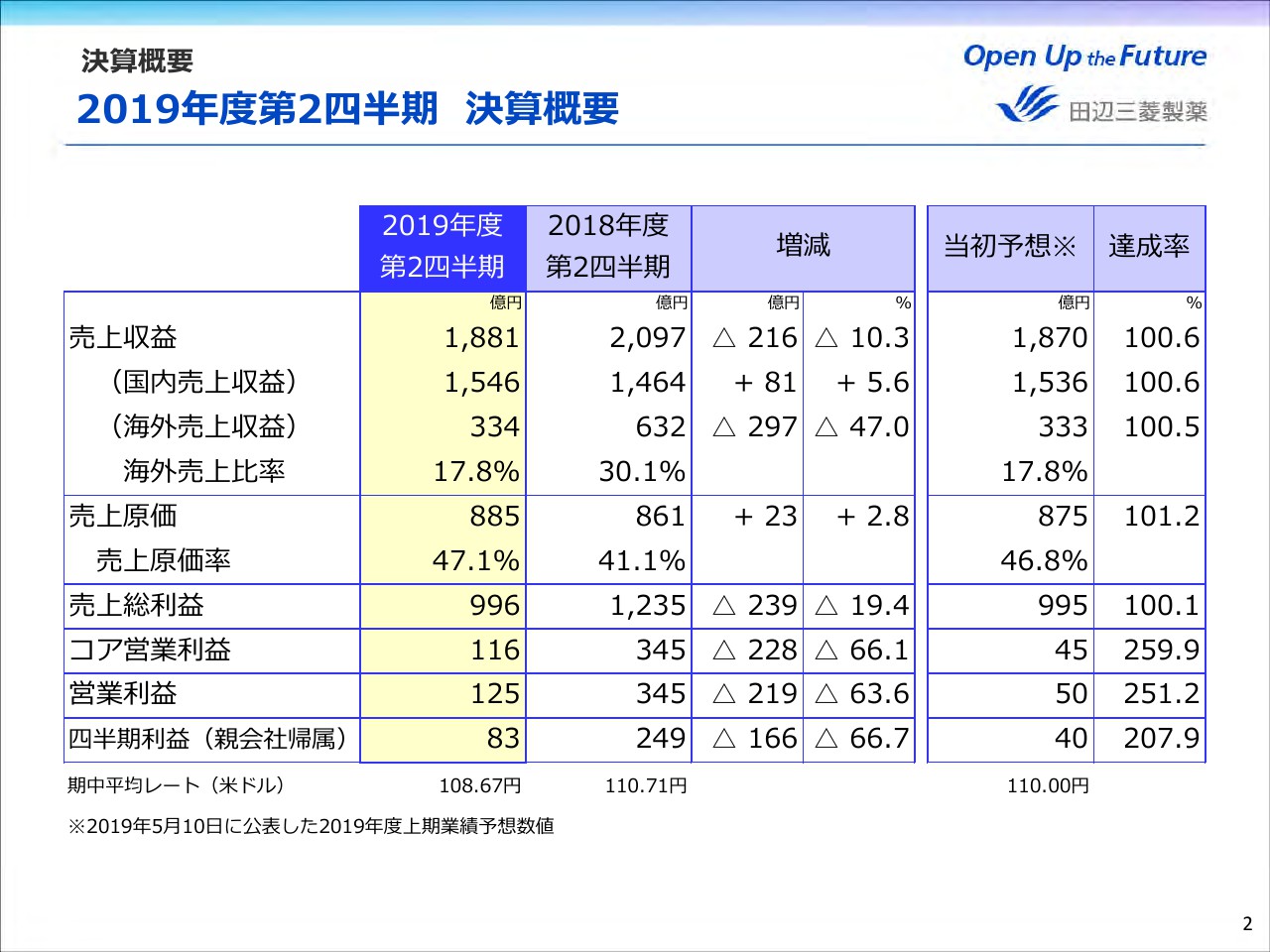
まず、2019年度第2四半期決算概要についてご説明します。ページ2をご覧ください。売上収益につきましては、当期第2四半期では引き続き国内重点品が伸長しました。一方で、「ジレニア」ロイヤリティ収入に関しては、ノバルティス社の仲裁手続きが継続中であるため、IFRS第15号に従い、その一部について売上収益の認識を行わない結果、前年同期比でマイナス10.3パーセント、216億円減収の1,881億円になりました。
各段階損益は主に「ジレニア」ロイヤリティの影響があり、減益となっています。売上総利益は996億円、コア営業利益は116億円、四半期利益は83億円となりました。なお、10月25日に業績予想の修正について公表したとおり、販管費および研究開発費が下期にずれ込んだことなどにより、コア営業利益以下の各段階利益は5月10日に公表した当初予想を大幅に上回る結果になっています。
売上収益の増減
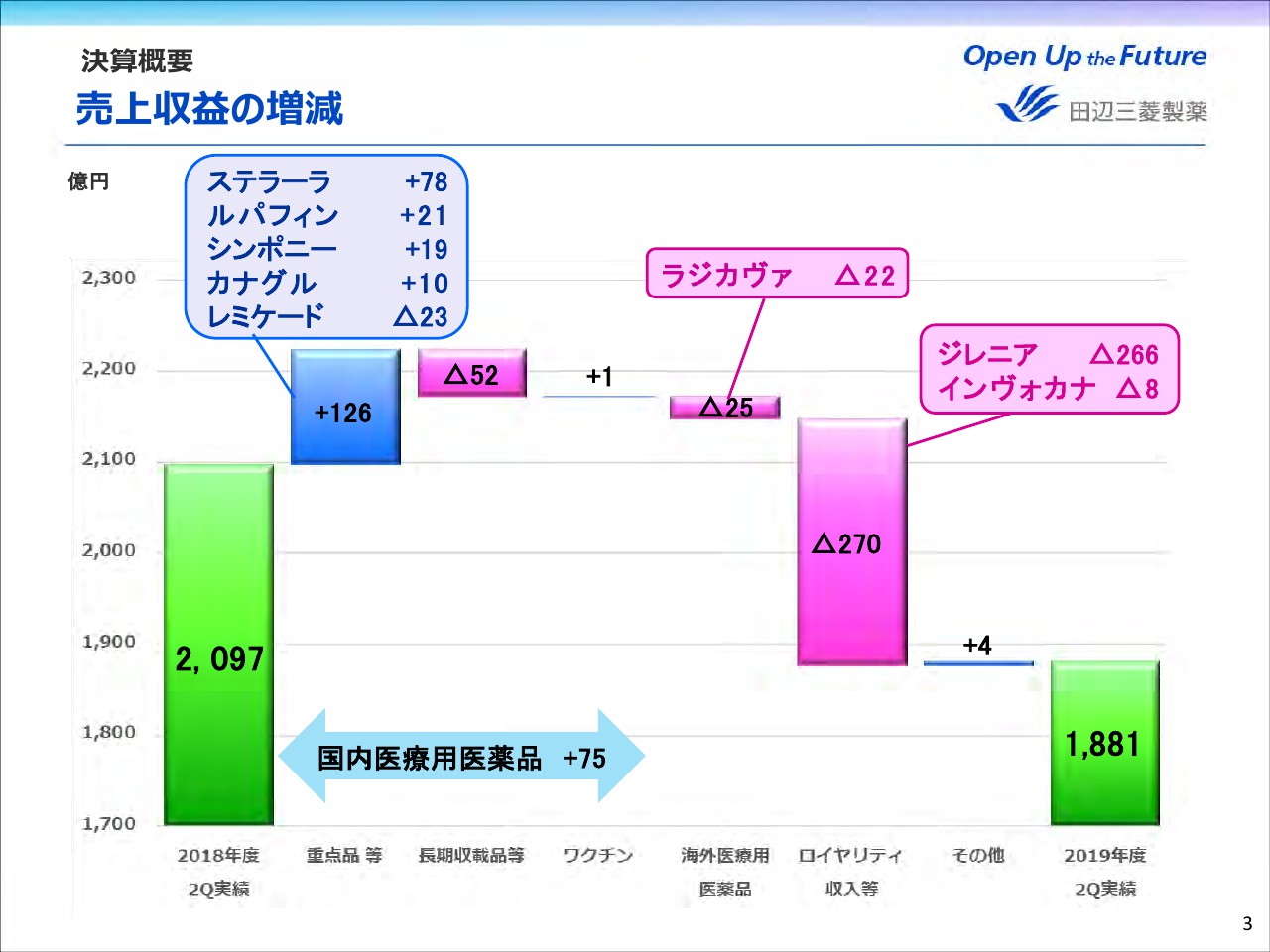
次に、売上収益の増減について、グラフにてご説明します。国内医療用医薬品においては、昨年よりヤンセンファーマと販売の枠組みを変更した「ステラーラ」の寄与、および「ルパフィン」「シンポニー」「カナグル」等の重点品の伸長により、前年同期比でプラス75億円となりました。
海外医療用医薬品においては、前年同期比でマイナス25億円となりました。「ラジカヴァ」は待機患者さんへの処方が一巡したこと等によりマイナス22億円となりましたが、「ラジカヴァ」の売上収益としては今年度の予想の水準にあります。なお、「ラジカヴァ」の投薬患者数は9月末現在で累計約4,200名となっています。
ロイヤリティ収入につきましては「ジレニア」の減少等により前年同期比でマイナス270億円となりました。これらの結果、売上収益は前年同期比でマイナス216億円の1,881億円となっています。
売上原価・販管費・コア営業利益
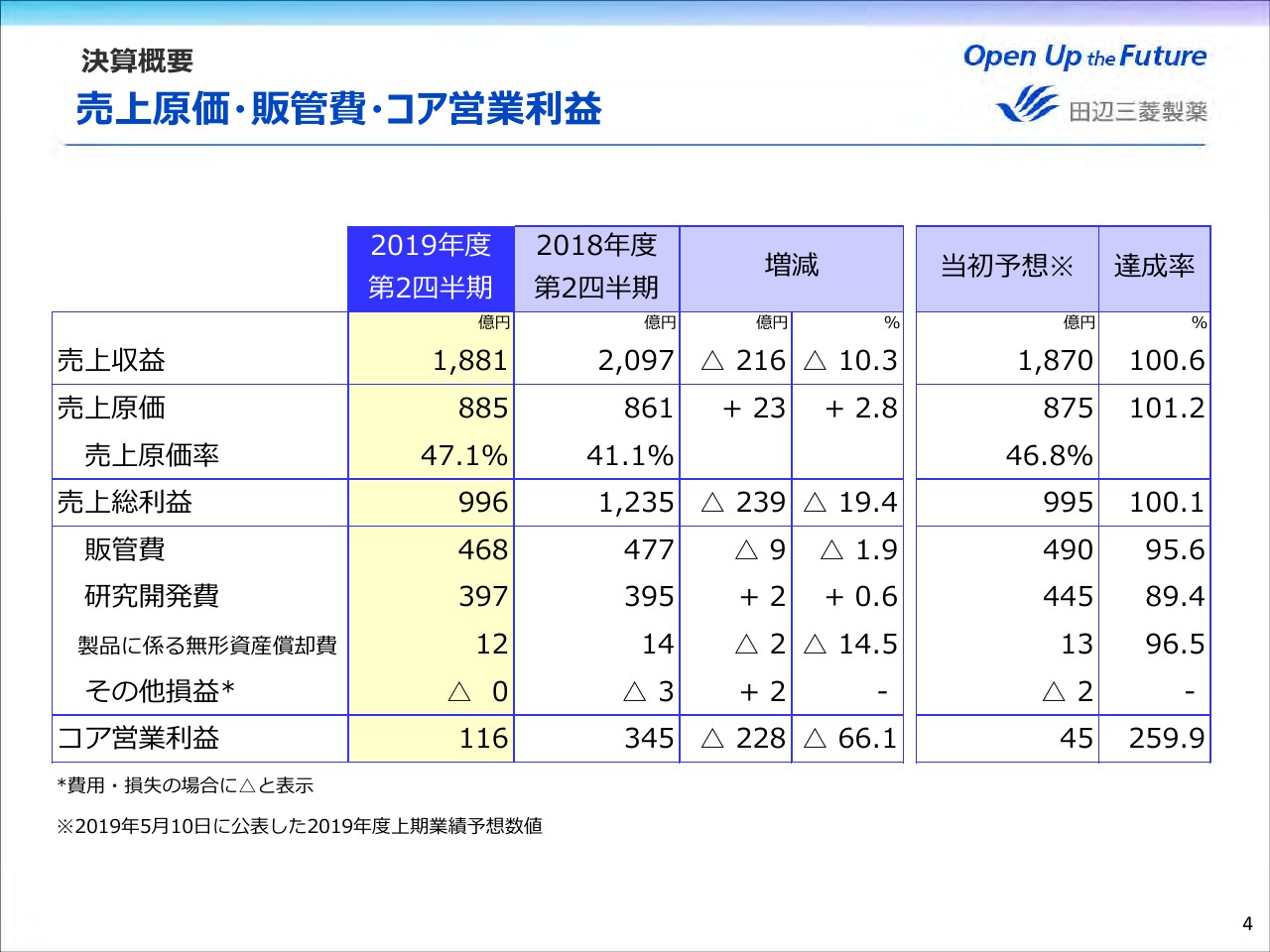
続いて、売上原価・販管費・コア営業利益についてご説明します。売上原価は23億円増加しました。売上原価率は、品目構成の変化、ロイヤリティ収入の大幅な減少等により、前年同期比6.0ポイント上昇の47.1パーセントとなっています。
販管費は前年同期比でやや減少しました。研究開発費はほぼ横ばいとなり、当初予想を下回っています。これらの結果、コア営業利益は228億円減益の116億円となりました。当初予想の比較につきましては、ご覧のとおりです。
非経常項目・四半期利益
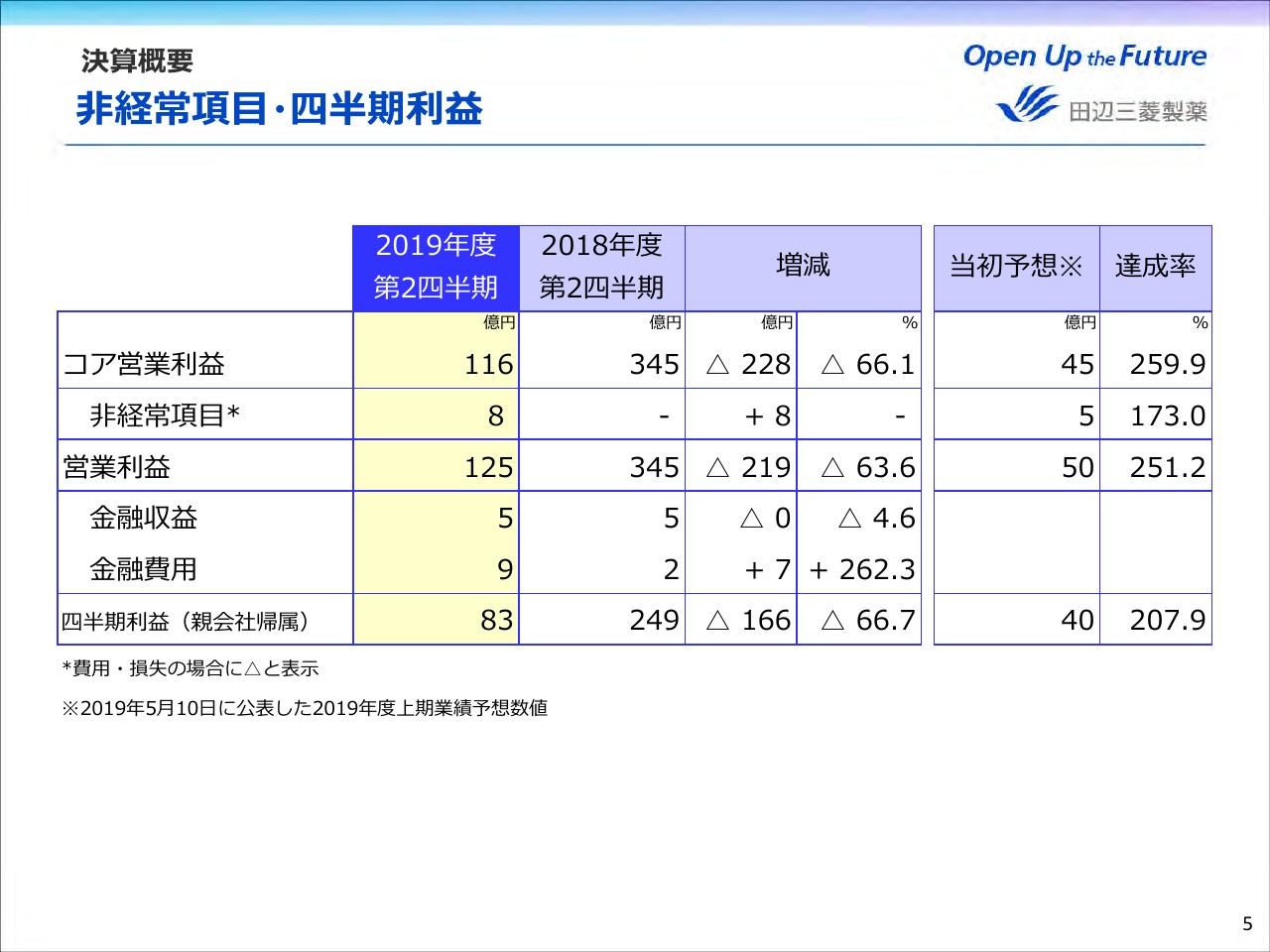
次に、コア営業利益以降について、営業利益は219億円減益して125億円となりました。金融損益についてはご覧のとおりです。費用については為替差によるものです。これらの結果、四半期利益は166億円減益の83億円となりました。
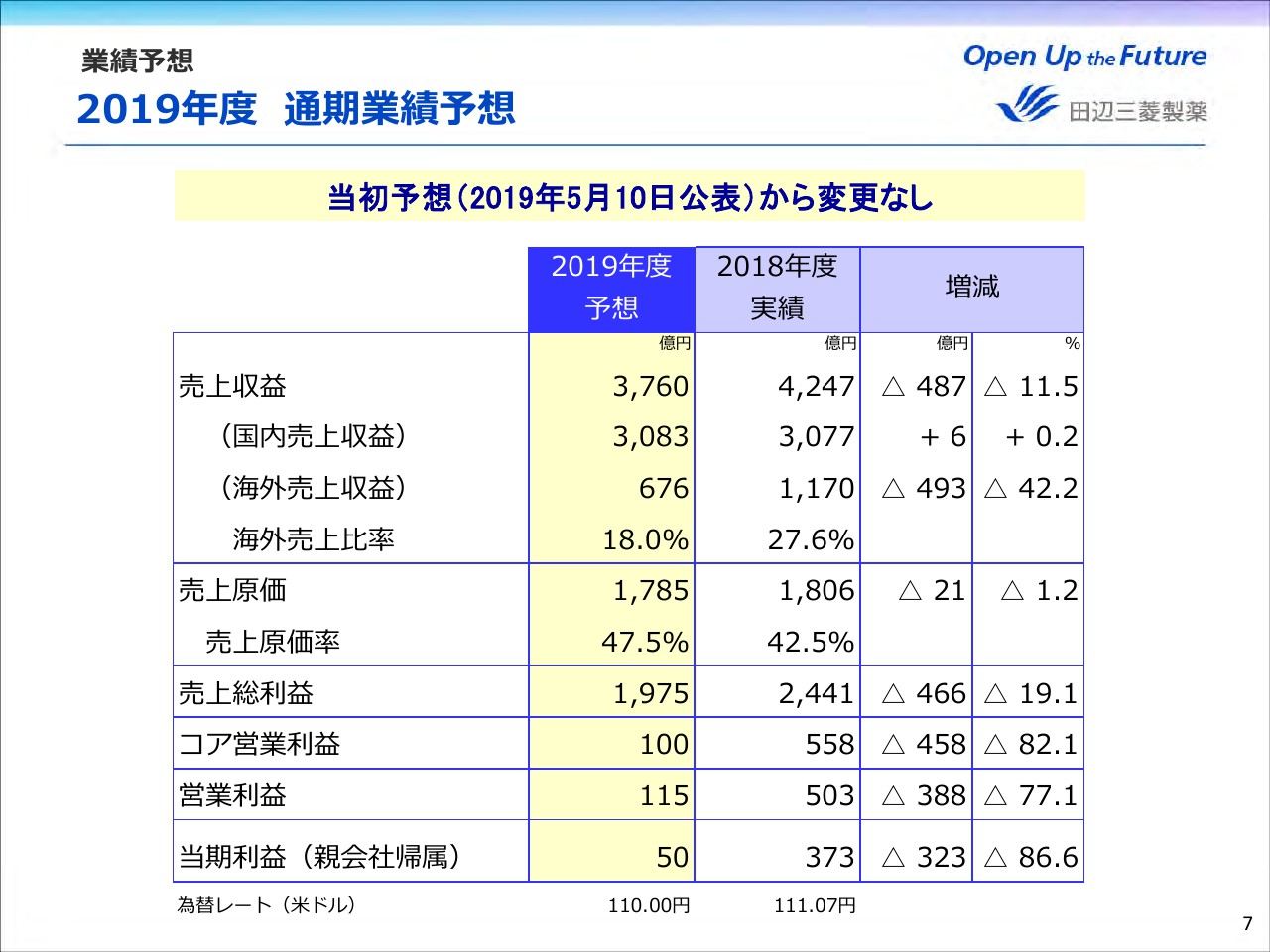
2019年度 通期業績予想
次に、2019年度の業績予想についてご説明します。ページ7をご覧ください。2019年度通期の業績予想につきましては「ジレニア」のロイヤリティ収入に関して、下期もノバルティス社との仲裁手続きが継続していることを見込んでいる一方で、上期からずれ込んでいる経費が、通期では予定どおり発生すると見込んでおり、当期予想から変更していません。ご覧のとおりでございます。
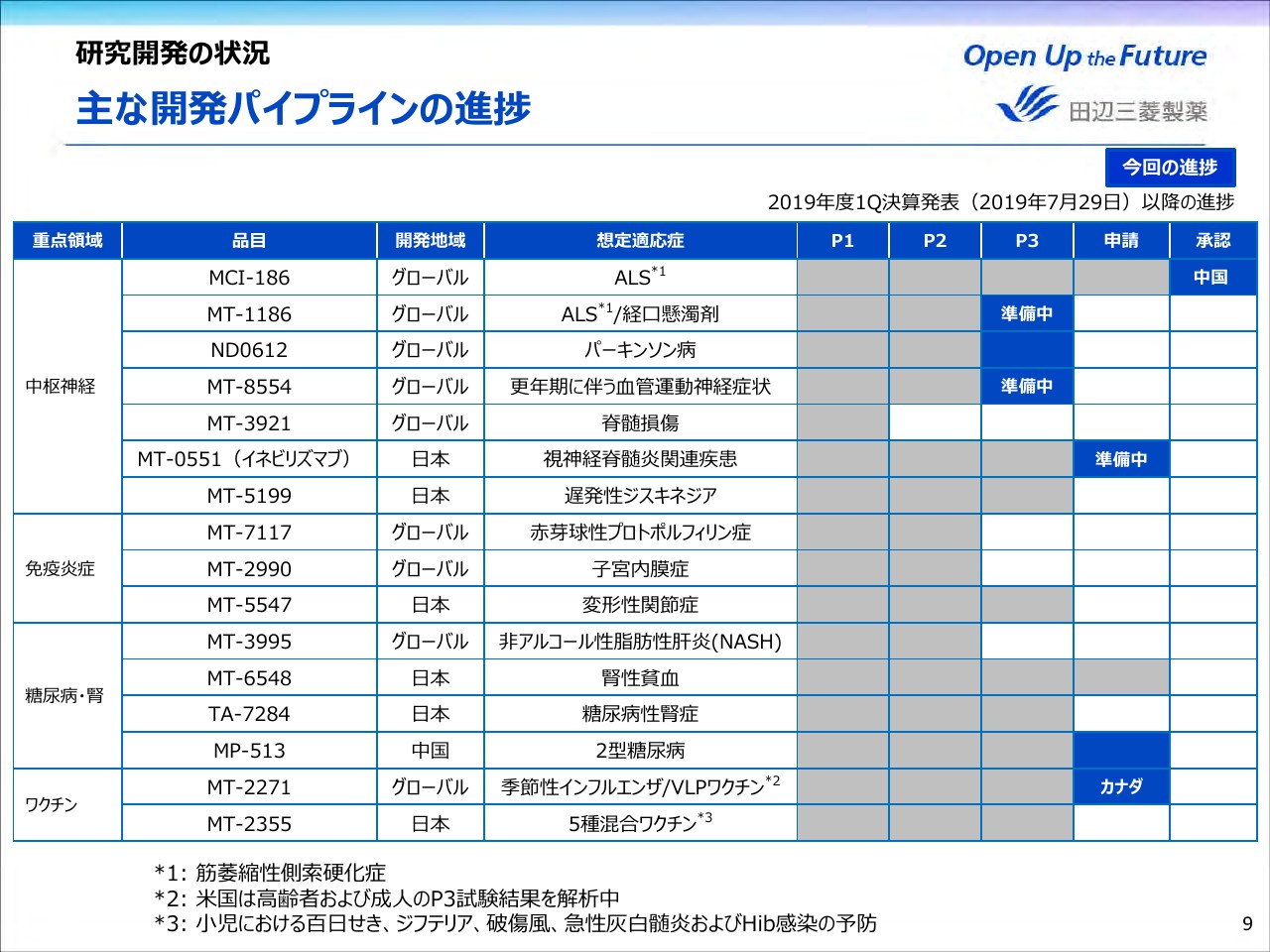
主な開発パイプラインの進捗
続きまして、これより研究開発の状況についてご説明します。ページ9をご覧ください。こちらは主な開発パイプラインの状況を示したものです。2019年度第1四半期決算発表以降に進捗のあったものは青くハイライトしています。進捗のあったものにつきましては、次以降のスライドにてご紹介いたします。
グローバル後期開発品の状況
ページ10をご覧ください。当社のグローバル後期開発品について、各プロジェクトの進捗をご説明します。ALS治療薬「ラジカヴァ」は、各国・地域への承認申請を並行して進めており、日本・韓国・米国・カナダ・スイスに続き7月には中国でも承認を取得しました。
「ラジカヴァ」の経口剤である「MT-1186」は10月にFDAよりファストトラック指定を受けています。12月には長期安定性試験を開始する予定です。
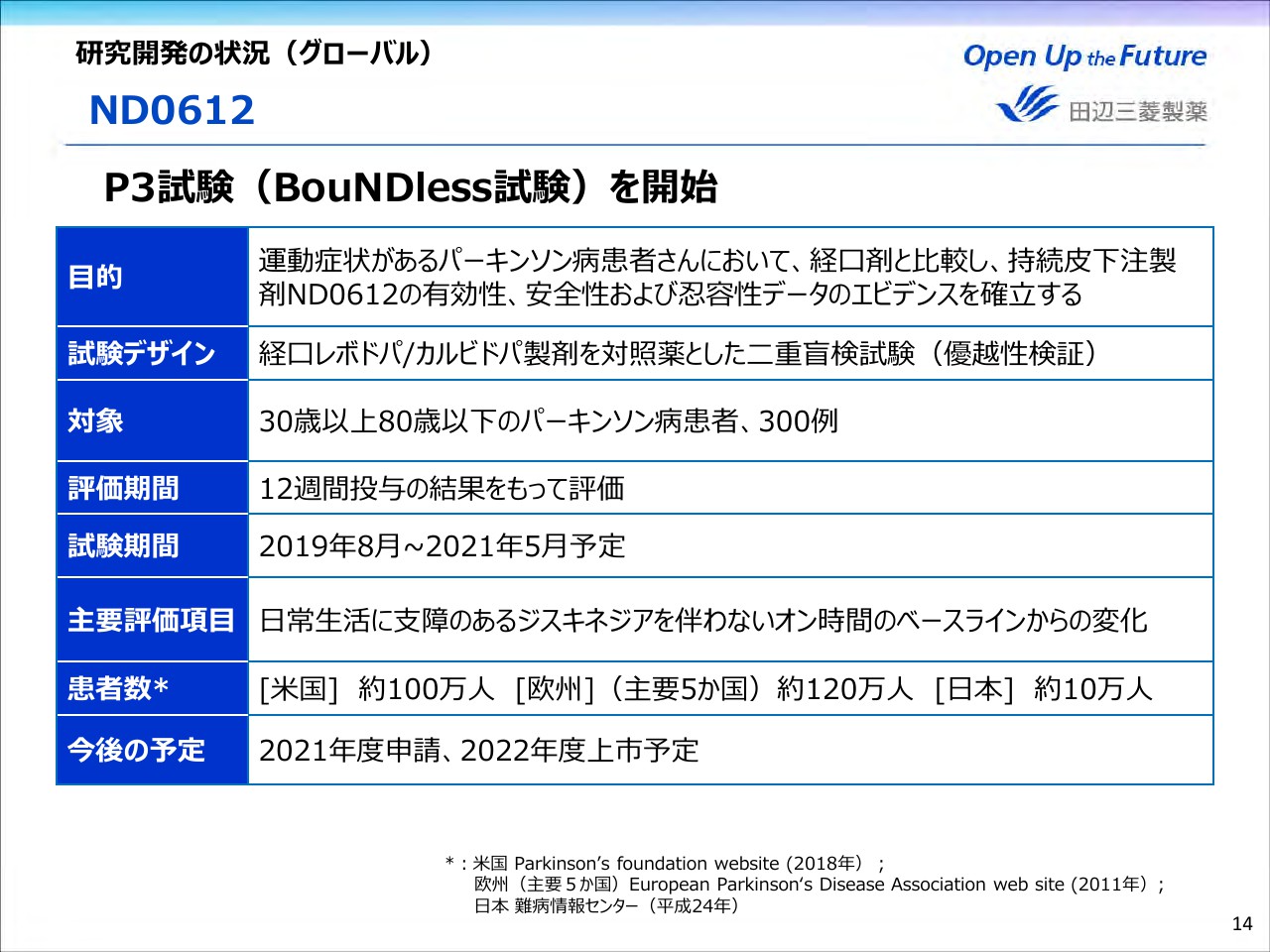
パーキンソン病治療薬の「ND0612」は、長期安定性試験において目標とする12ヶ月投与100例を達成いたしました。また、経口剤との比較試験であるP3試験(BouNDless試験)を8月に開始いたしました。
季節性インフルエンザVLPワクチンである「MT-2271」は、9月にカナダで申請いたしました。米国では高齢者および成人のデータを解析中であり、申請に向けて当局との協議を予定しています。
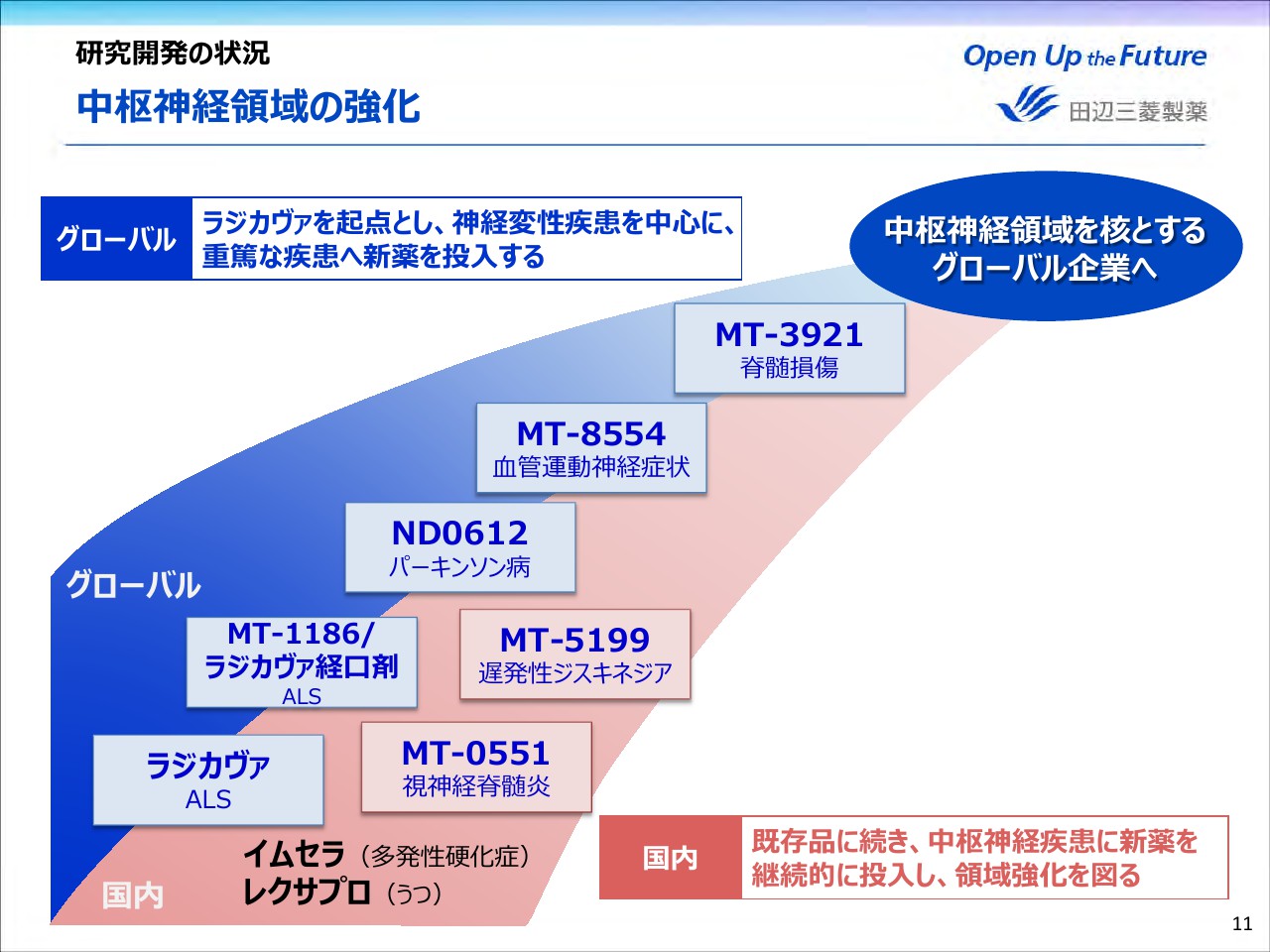
中枢神経領域の強化
次に、当社の中枢神経領域強化に向けた取り組みを中心にご紹介します。当社は中枢神経領域を核とするグローバル企業を目指し、グローバルでは「ラジカヴァ」を起点として、神経変性疾患を中心に、パーキンソン病を対象とした「ND0612」や、脊髄損傷を対象とした「MT-3921」など、重篤な疾患の新薬を投入していきます。
また国内では、多発性硬化症治療薬「イムセラ」やうつ病治療薬「レクサプロ」に続き、グローバル品の国内展開に加え「MT-0551(イネビリズマブ)」や「MT-5199」など、中枢神経領域に新薬を継続的に投入し、領域強化を図ってまいります。
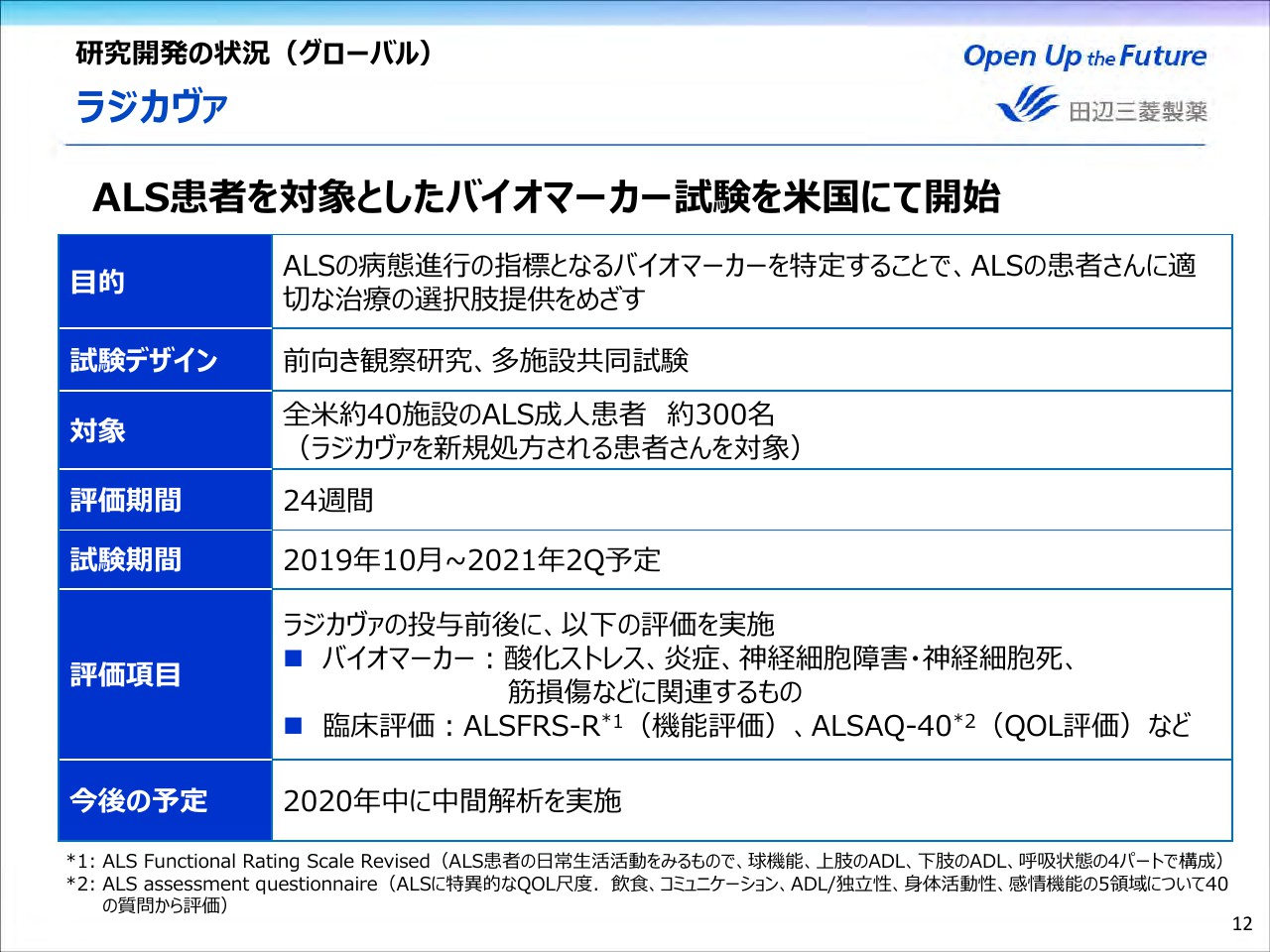
ラジカヴァ
それでは、各品目の進捗についてご説明します。ページ12をご覧ください。まず「ラジカヴァ」につきまして、ALS患者さんを対象としたバイオマーカー試験を米国で開始いたしました。
全米の約40施設で300名のALS患者さんを対象に、「ラジカヴァ」の投与前・投与後でバイオマーカーの測定と臨床評価を行います。この試験でALSの病状進行の指標となるバイオマーカーを特定し、ALS患者さんにより適切な治療の選択肢を提供できるよう取り組んでまいります。
MT-1186(ラジカヴァ経口剤)
次に、「ラジカヴァ」の経口剤である「MT-1186」の状況です。2019年7月にFDAと、8月にPMDAと、申請までの開発計画について合意いたしました。今後は、年内に長期安定性試験を開始し、24週のデータを入手後、速やかにFDAへ申請します。
すでに経口剤と注射剤の生物学的同等性試験は完了し、静注剤と同様の薬物動態プロファイルを確認済みです。10月にはFDAよりファストトラック指定を受けました。米国で2021年の上市を予定しています。
ND0612
次に、「ND0612」の進捗についてご説明します。8月にプレスリリースしたとおり、欧米でP3試験を開始しました。このP3試験の目的は、運動症状があるパーキンソン病患者さんにおいて、経口剤のレボドパ/カルビドパと比較し、持続皮下注製剤である「ND0612」の有効性、安全性、および忍容性データのエビデンスを確立することにあります。
経口レボドパ/カルビドパ製剤を対照薬とした二重盲検(ダブルブラインド)試験で12週の評価を行い、「ND0612」の優越性を検証いたします。2021年に申請、2022年の上市を予定しています。
MT-8554
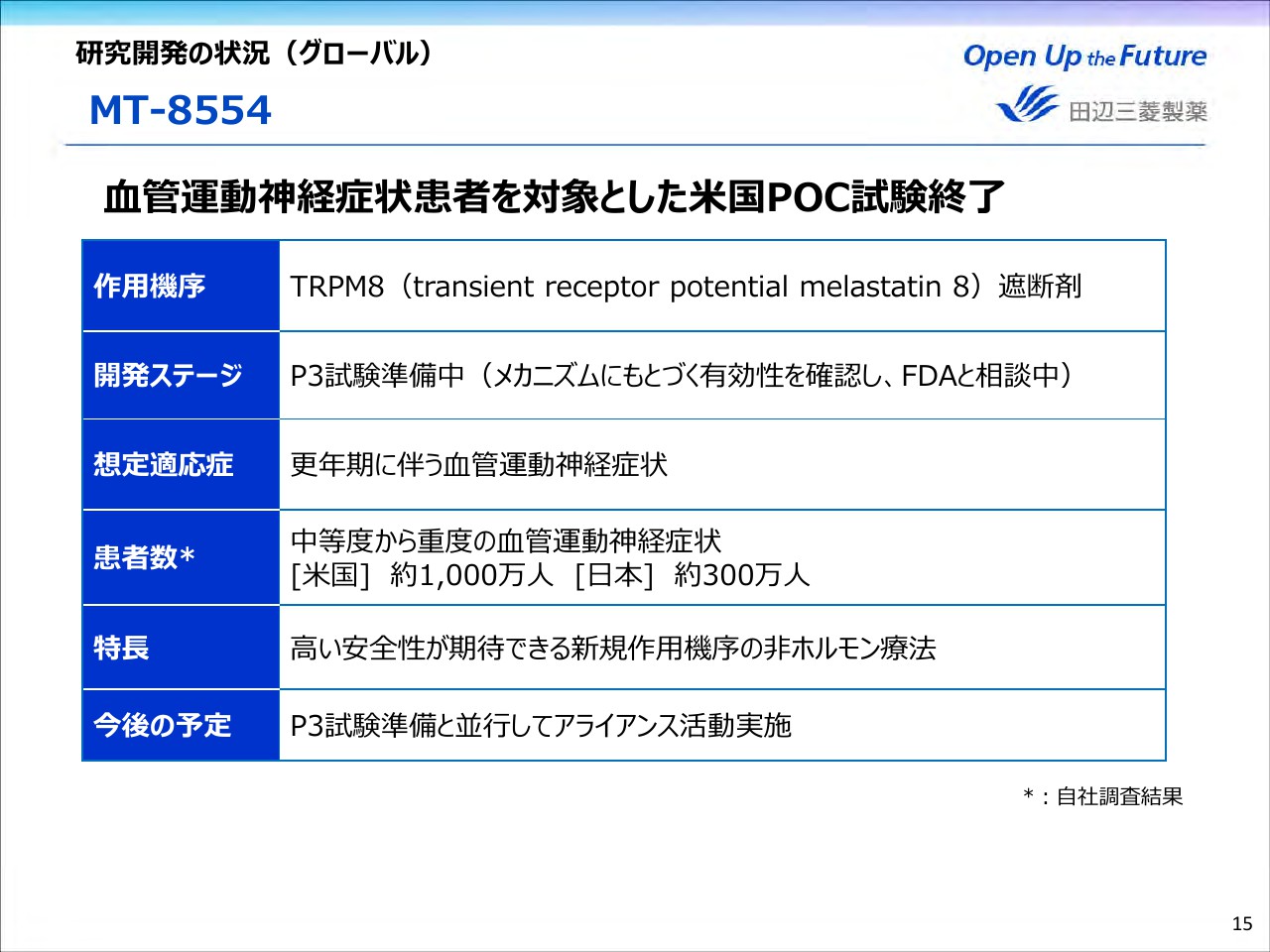
次は、「MT-8554」でございます。血管運動神経症状患者さんを対象として、米国でP2試験が終了し、メカニズムに基づく有効性を確認いたしました。現在、P3試験の準備をしています。更年期に伴う血管運動神経症状に対し、高い安全性が期待できる新規作用機序の非ホルモン療法として、P3試験の準備と並行し、アライアンス活動を実施しています。
MT-3921
次に、「MT-3921」でございます。大阪大学との共同研究により創製した、ヒト化抗RGMa抗体です。本剤はRGMaの作用をブロックすることで、神経軸索の伸展を促します。また、RGMaは炎症反応にも関与しており、本剤は炎症抑制作用も有しています。これらの作用により、脊髄損傷後の神経再生を促進することが期待されます。
現在、国内で健康成人を対象としたP1試験を実施中です。6月には、米国にて実施予定の外傷性脊髄損傷を対象とするP1試験の計画をFDAに提出いたしました。年内には開始する予定でございます。
MT-0551(イネビリズマブ)
次に、「MT-0551(イネビリズマブ)」についてご説明します。10月8日、Viela Bio社とライセンス契約を締結し、視神経脊髄炎関連疾患であるグローバルP3試験を終了している本剤の、日本およびアジアにおける独占的開発・商業化権を獲得いたしました。
問題はヒト化抗CD19モノクローナル抗体です。CD19を発現するB細胞、および、自己抗体を産出する形質芽細胞を除去する作用を有し、1日目と15日目、その後は6ヶ月に1回の単剤投与でございます。
さらに総合障害度において、臨床的意義のある抑制効果を見出されています。視神経脊髄炎関連疾患は、国内ではいまだ承認された治療薬がなく、アンメットニーズの高い疾患であり、国内の患者数は約5,000名とされています。現在、国内申請の準備中であり、2020年度に申請、2021年度の上市を予定しています。
MT-5199(Valbenazine)
続いて、「MT-5199」についてご説明します。国内でP2/3試験を実施中で、症例の組み入れが終了しました。こちらに概要を示しています。本剤は、小胞モノアミントランスポータータイプ2阻害剤で、2015年に米国ニューロクラインバイオサイエンス社から導入をいたしました。米国では、すでに遅発性ジスキネジアの承認を取得し、「INGREZZA」として上市済みです。
米国の革新的な医薬品開発に与えられる権威ある賞である「プリ ガリアン賞」にもノミネートされた薬剤です。日本では揮発性ジスキネジアの適応を有する治療薬はいまだになく、患者さんに新たな治療を提供できるよう、開発を進めてまいります。本剤は2021年度に申請、2022年度の上市を予定しています。
主なパイプラインの上市計画
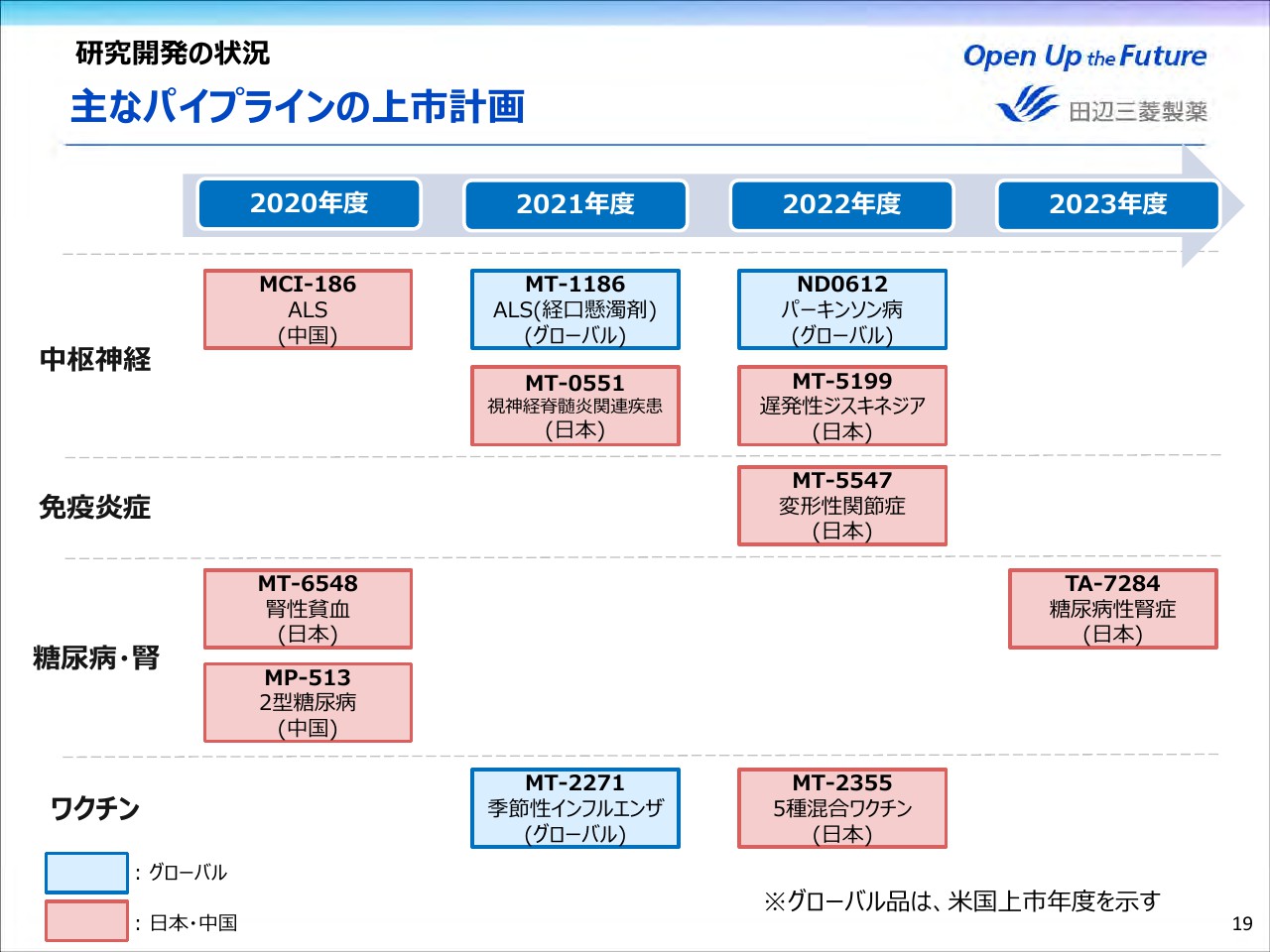
19ページ。こちらは、主なパイプラインの上市計画でございます。ご覧のとおりでございます。
配当金推移
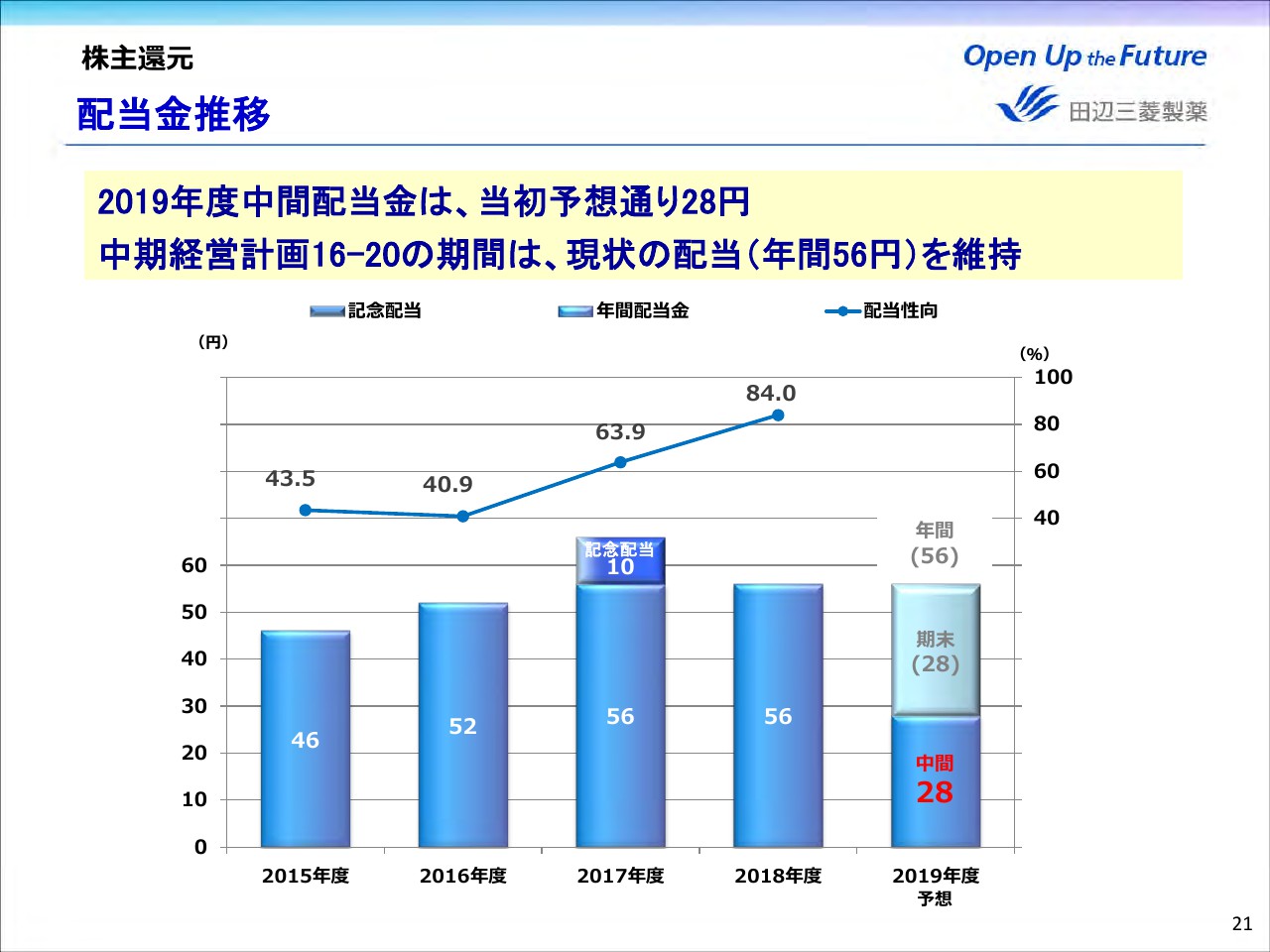
最後に、株主還元についてご説明します。配当につきましては、当初の予想どおり、中間配当は28円といたします。2018年11月に公表した中期経営計画の見直しに基づき、本中計期間中は現状の年間配当56円を維持する予定でございます。私からの説明は以上になります。ありがとうございました。