2019年9月11日に行われた、第一三共株式会社2020年3月期第1四半期決算説明会の内容を書き起こしでお伝えします。IR資料
スピーカー:第一三共株式会社 代表取締役副社長/CFO 齋寿明 氏
第一三共株式会社 執行役員研究開発本部長/オンコロジー統括部長 高崎渉 氏
連結業績の概要
齋寿明氏:齋でございます。本日はご多忙のところ、第一三共の決算カンファレンスコールにご参加いただきありがとうございます。
本日13時に発表いたしました2019年度第1四半期決算に関しまして、資料に基づき説明させていただきます。
本日お話する内容でございますが、2019年度第1四半期の決算内容、ビジネスアップデートの順番でお話します。その後、2019年4月より新たに研究開発部長となりました高崎から研究開発アップデートについてお話します。
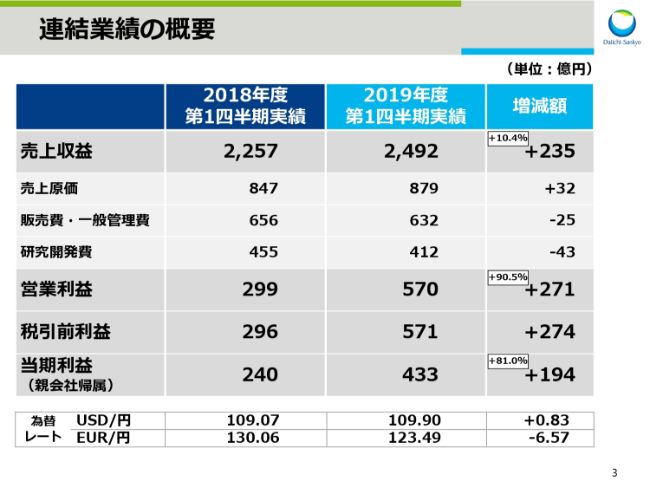
スライド3をご覧ください。まず2019年度第1四半期の連結業績の概要です。
売上収益は2,492億円、前年同期比で235億円となり、10.4パーセントの増収となりました。売上原価は、前年同期比で32億円増、販売費・一般管理費は25億円減、研究開発費は43億円減となりました。
この結果、営業利益は570億円で、前年同期比で271億円増となり、90.5パーセントの増益となりました。親会社帰属の当期利益は433億円、前年同期比で194億円となり、81.0パーセントの増益となりました。
為替レートの実績です。1ドルは109円90銭となり、前年同期よりも83銭の円安で、1ユーロは123円49銭となり、前年同期よりも6円57銭の円高となりました。
売上収益増減
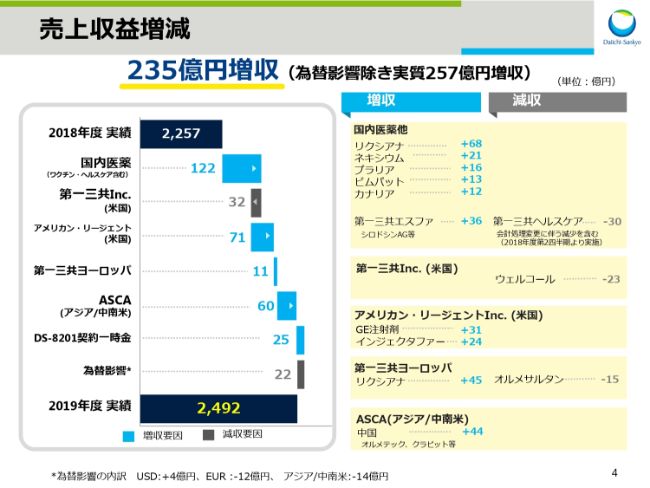
スライド4をご覧ください。ここからは、4枚のスライドを使い、前年同期比での増減要因について説明いたします。
売上収益は、前年同期比で235億円の増収となりましたが、その内訳を主要事業ユニット別にご説明いたします。
まず、国内医薬です。ワクチン・ヘルスケアを含む日本事業では、直接経口抗凝固剤「リクシアナ」、抗潰瘍剤「ネキシウム」、骨粗鬆症治療剤「プラリア」、抗てんかん剤「ビムパット」、2型糖尿病治療剤「カナリア」に加え、オーソライズドジェネリックを含めた第一三共エスファの商品を中心に売上を拡大しました。
第一三共ヘルスケアについては30億円の減収となりましたが、これは会計基準の変更にともない、2018年度第2四半期より従来販売費および一般管理費として経費計上していた販売奨励金の会計処理を変更したことによります。日本事業全体では122億円の増収となりました。
次に、海外営業について説明いたします。ここでは、為替変動の影響を除外したかたちで記載しています。
米国の第一三共Inc.は、高コレステロール血症治療剤・2型糖尿病治療剤「ウェルコール」の減収等により、32億円の減収となりました。
一方、米国のアメリカン・リージェントは、ジェネリック注射剤および鉄欠乏性貧血治療剤「インジェクタファー」の伸長により、71億円の増収となりました。
第一三共ヨーロッパは「リクシアナ」の売上拡大により11億円の増収となりました。
続いて、アジア中南米地域を担当するASCA事業です。中国で「オルメテック」「クラビット」を中心に44億円増収となり、ASCA事業全体では60億円の増収となりました。
また、2019年3月にアストラゼネカ社と契約を締結したDS-8201の契約一時金の当第1四半期認識分として、25億円を計上し増収となりました。なお、為替による減収は全体で22億円でございました。
営業利益増減
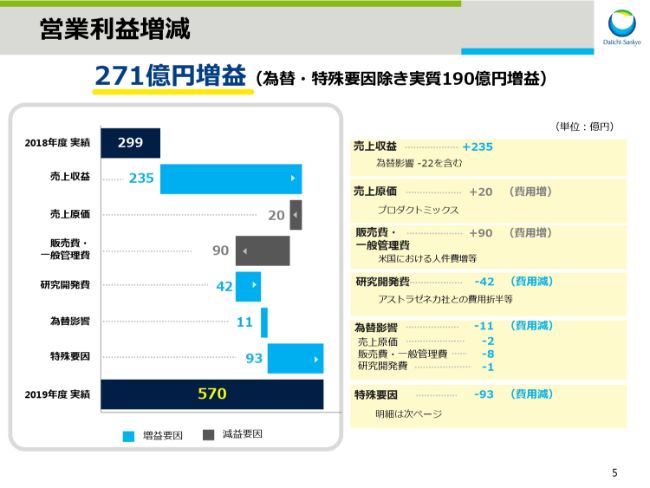
スライド5をご覧ください。営業利益は271億円の増益となりましたが、項目別に説明いたします。先ほどの説明のとおり、売上収益は為替影響による減収22億円を含めて、235億円の増収となりました。
売上原価については、売上収益が大きく増収となったものの、プロダクトミックスの影響により20億円増に留まりました。
販売費・一般管理費は、米国における人件費増の影響等により90億円増となりました。研究開発費は、アストラゼネカ社とのDS-8201に係る費用折半の影響もあり42億円減となりました。
為替影響による費用減は、11億円でした。
特殊要因として、今期は前期と比較すると93億円の費用減となりました。詳細は次のスライドで説明いたします。なお、為替と特殊要因による影響を除外すると、実質で190億円の増益でした。
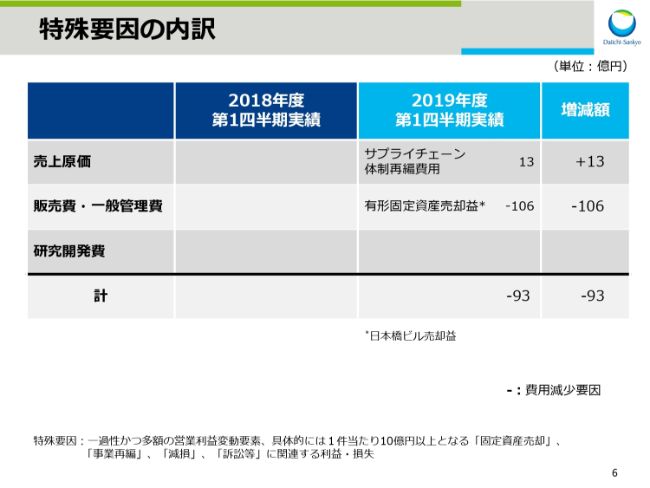
特殊要因の内訳
スライド6をご覧ください。特殊要因の内訳です。今期はサプライチェーン体制の再編費用が13億円、有形固定資産売却益が106億円ありました。
この結果、今期は前期に比べ93億円の費用減となりました。
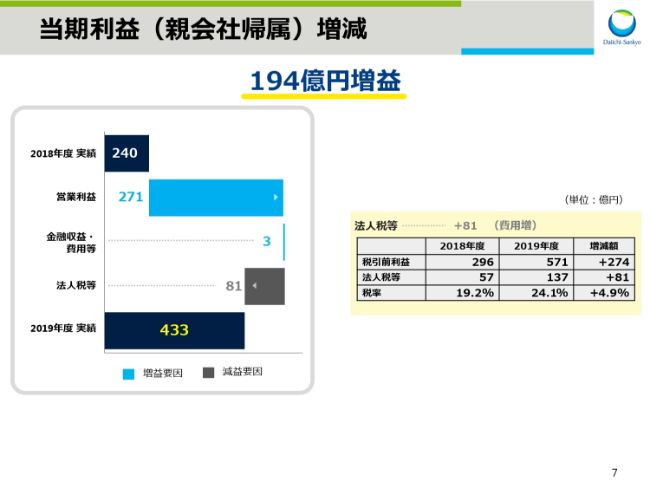
当期利益(親会社帰属)増減
スライド7をご覧ください。当期利益に関して説明いたします。営業利益が271億円の増益となりましたが、法人税等が81億円増加した結果、親会社帰属の当期利益は433億円、対前年194億円の増益となりました。
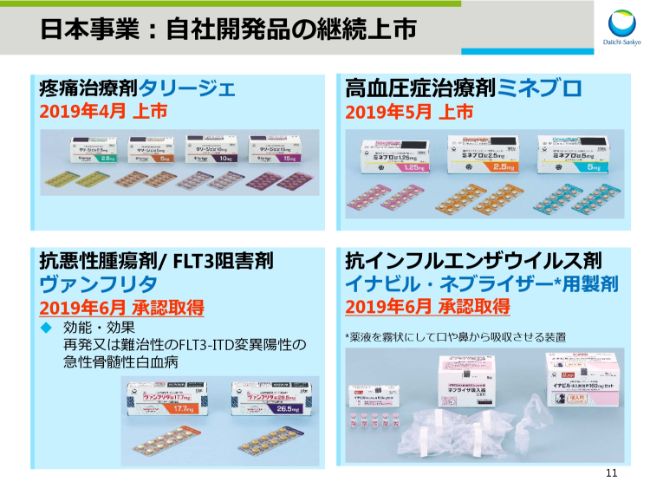
日本事業:自社開発品の継続上市
スライド11は日本事業の新製品についてであります。新製品として、疼痛治療剤「タリージェ」を4月、高血圧症治療剤「ミネブロ」を5月に上市しました。
また6月には、抗悪性腫瘍剤/FLT3阻害剤「ヴァンフリタ」、抗インフルエンザウイルス剤「イナビル」のネブライザー用製剤の承認を取得しました。
日本事業:造影剤事業の承継
スライド12をご覧ください。事業ポートフォリオの最適化の一環として、「オムニパーク」を初めとした造影剤事業をGEヘルスケアファーマ株式会社に承継することを決定しました。
2020年3月に製造販売承認の承継を行います。その後、2022年3月にGEヘルスケアファーマの卸を通じた販売が開始されます。
以降は研究開発アップデートについてです。ここで研究開発本部長の高崎にバトンタッチします。
高崎渉氏:高崎でございます。本日は私より研究開発のアップデートについてお話させていただきます。
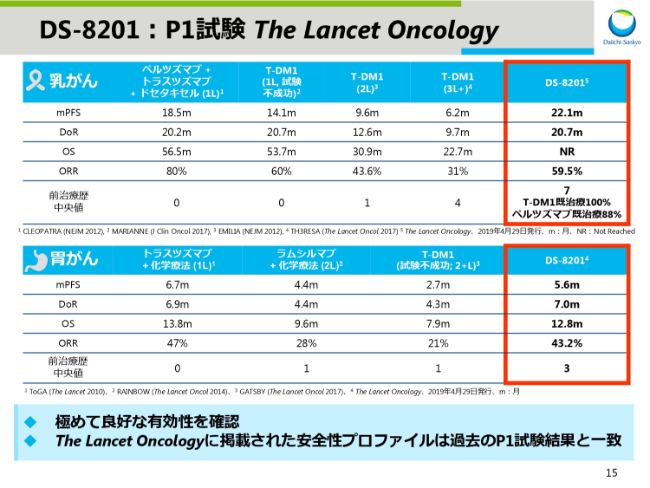
スライド15は2019年4月末に「The Lancet Oncology」に掲載されたDS-8201PhaseⅠ試験の、乳がんおよび胃がんのデータです。
本PhaseⅠ試験では、多くの薬剤で治療された患者さんに対して、DS-8201が投与されていますが、乳がん・胃がんともに極めて良好な有効性が確認できました。
スライドにはお示ししておりませんが、安全性についても、これまでに得られた結果と一致しております。
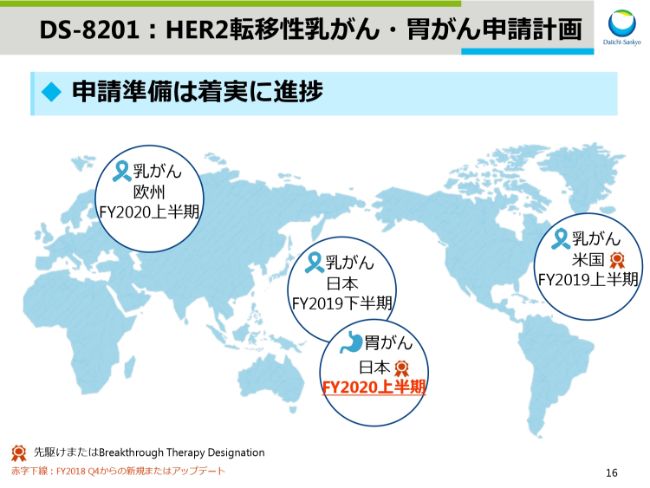
DS-8201:HER2転移性乳がん・胃がん申請計画
スライド16では、HER2陽性・転移性乳がんおよび胃がんの申請計画をお示ししています。
乳がんの日米欧での申請準備は順調に進んでおります。日本における胃がんの承認申請は2020年度の上半期を予定しております。
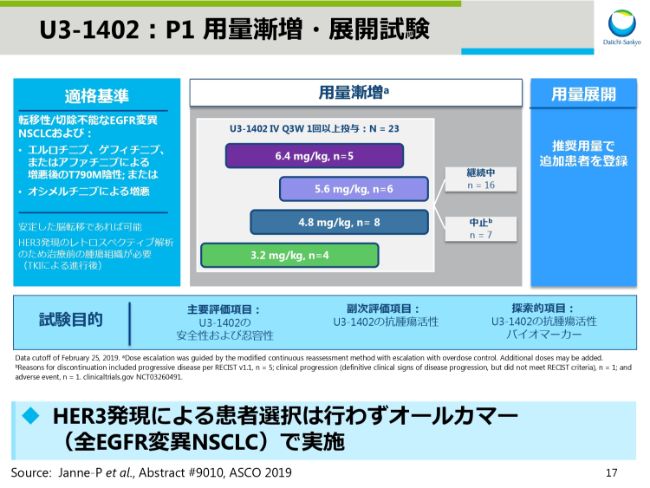
U3-1402:P1 用量漸増・展開試験
スライド17からは、米国臨床腫瘍学会(ASCO)で発表したU3-1402のデータをご紹介します。
このスライドは、EGFR変異のある非小細胞肺がんを対象としたPhaseⅠ試験の治験デザインです。本試験では、HER3発現による事前の患者選択を行わずに、オールカマーで患者さんの登録を行なっております。
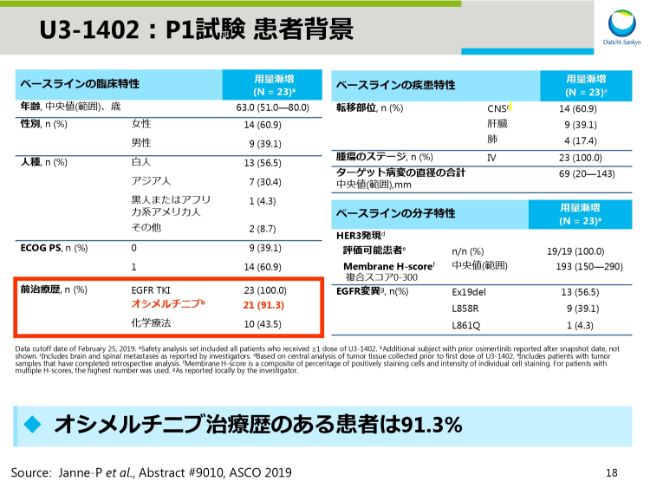
U3-1402:P1試験 患者背景
スライド18は患者背景です。全員がチロシンキナーゼ阻害剤による治療を受けており、そのうち91.3パーセントの患者さんがオシメルチニブによる治療を受けています。
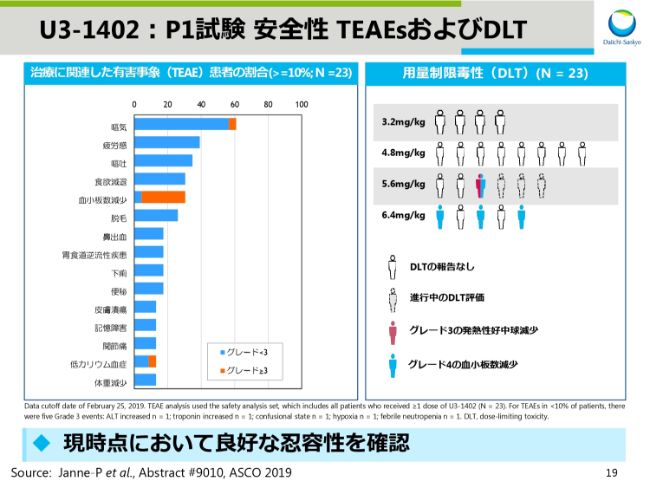
U3-1402:P1試験 安全性 TEAEsおよびDLT
スライド19は、安全性のサマリーです。用量制限毒性として血小板数減少などが起きているものの、現在のところ良好な忍容性が確認できています。
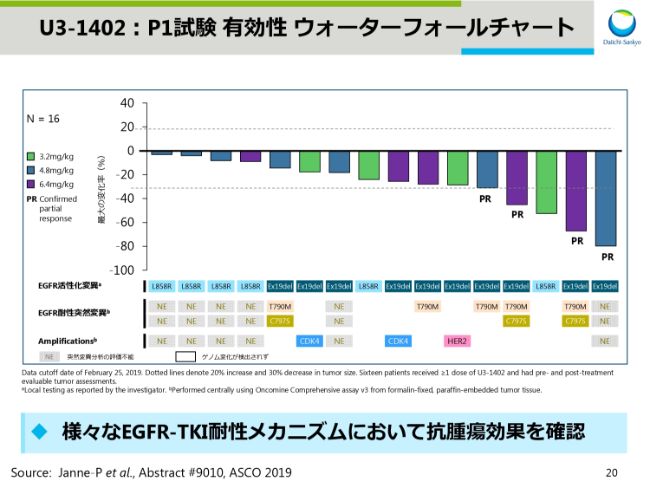
U3-1402:P1試験 有効性 ウォーターフォールチャート
スライド20は、有効性を示すウォーターフォールチャートです。すべての患者さんにおいて腫瘍縮小効果が確認でき、またオシメルチニブなどのチロシンキナーゼ阻害剤投与後に発生する、さまざまな耐性を持つ患者さんにおいても、抗腫瘍効果が確認できました。
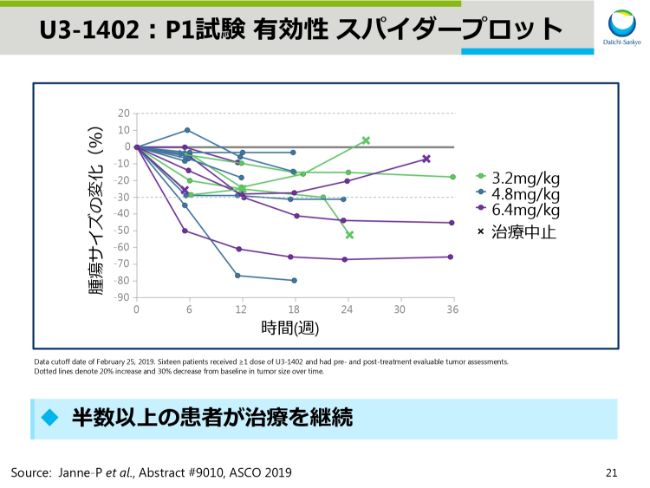
U3-1402:P1試験 有効性 スパイダープロット
スライド21は有効性を示すスパイダープロットです。半数以上の患者さんでU3-1402の投与を継続しております。
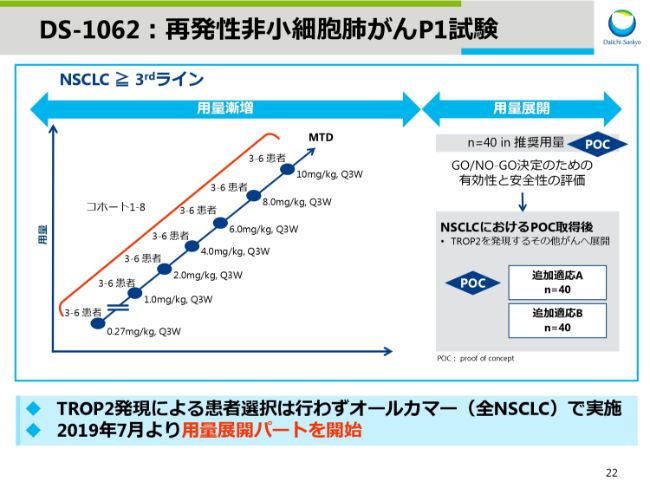
DS-1062:再発性非小細胞肺がんP1試験
スライド22からは、ASCOで発表したDS-1062のデータをご紹介します。
スライドは、再発性非小細胞肺がんを対象としたPhaseⅠ試験の治験デザインです。本試験では、標準治療が効果不十分もしくは開発したすべての患者さんを、TROP2発現による事前の患者選択を行わずに登録しております。
また、ASCOからのアップデートとして、2019年7月より用量展開パートを開始しました。
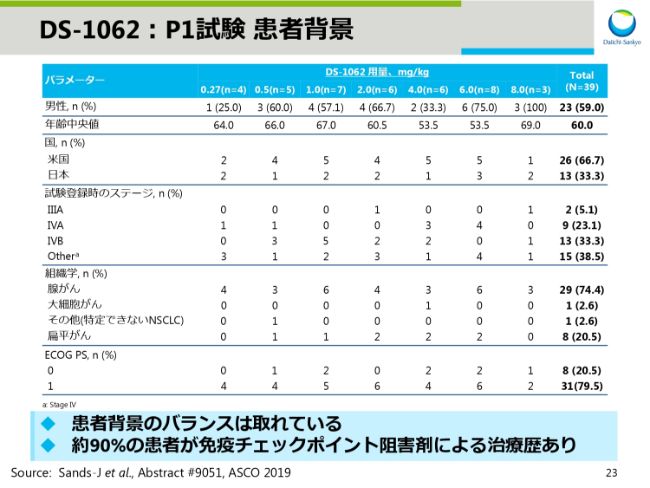
DS-1062:P1試験 患者背景
スライド23は患者背景です。患者背景にバラツキはなく、約90パーセントの患者さんが免疫チェックポイント阻害剤を使用しています。
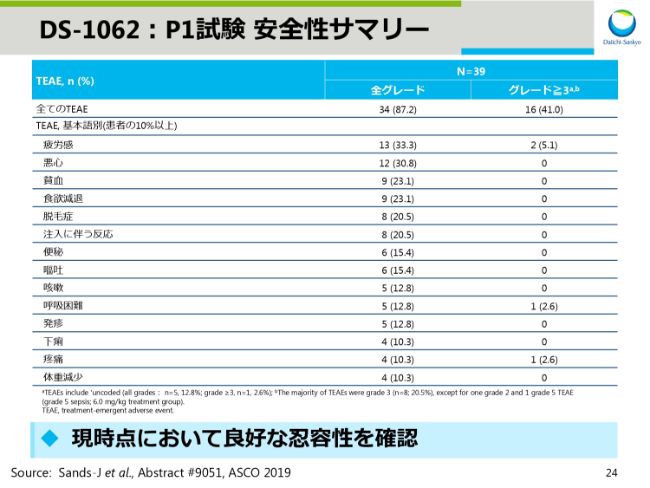
DS-1062:P1試験 安全性サマリー
スライド24は、安全性のサマリーです。現時点において良好な忍容性が確認できています。
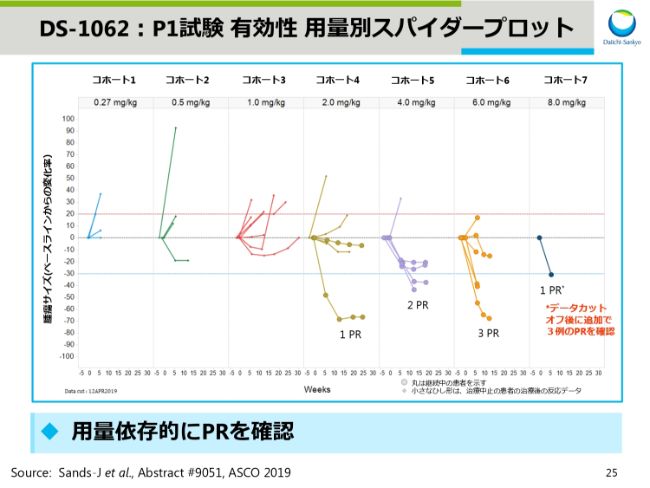
DS-1062:P1試験 有効性 用量別スパイダープロット
スライド25は、有効性を示す投与量別のスパイダープロットです。2ミリグラム/パーキログラム以上から「部分奏効(PR)」の患者さんが認められ、用量依存的に効果が確認できました。
またASCOの際にもご説明しましたが、コホート7の8ミリグラム/パーキログラムでは追加症例があり、4例全例でPRが確認できました。
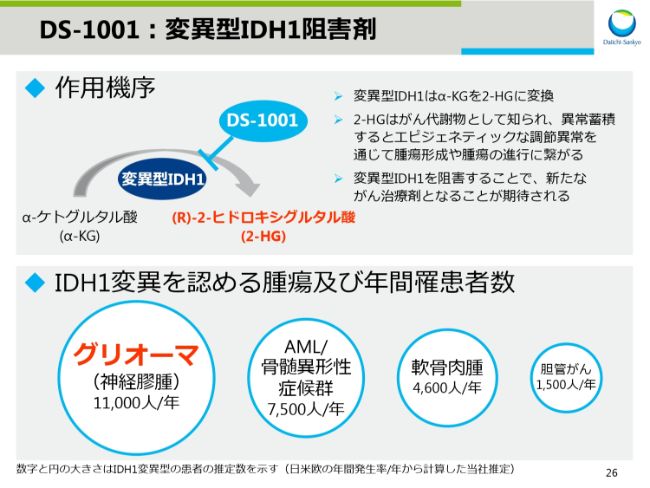
DS-1001:変異型IDH1阻害剤
スライド26からは、ASCOで発表したDS-1001のデータをご紹介します。DS-1001は変異型IDH1阻害剤です。
変異型IDH1はα-ケトグルタル酸を2-ヒドロキシグルタル酸(2-HG)に変換します。この2-HGはがん代謝物として知られ、蓄積すると腫瘍形成や腫瘍の進行に繋がると言われています。
よって、変異型IDH1を阻害することで、新たながん治療剤となることが期待されています。
現在、グリオーマ(神経膠腫)の患者さんを対象にPhaseⅠ試験を実施しています。IDH1変異を認めるグリオーマの患者さんは、日米欧で年間約1万1,000人と推定しています。
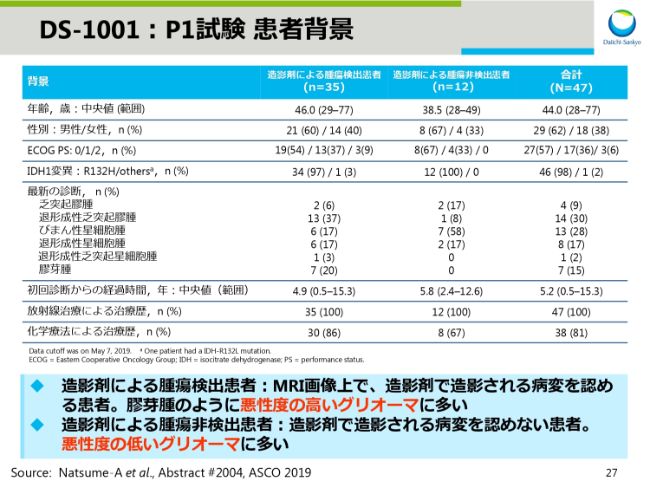
DS-1001:P1試験 患者背景
スライド27は、患者背景です。本試験では患者さんを2つのカテゴリーに分類しています。
1つ目は、造影剤による腫瘍検出患者で、MRI画像上で病変が認められる患者さんです。悪性脳腫瘍の中では膠芽腫のような悪性度の高いグリオーマの患者さんが多いのが特徴です。
もう1つのカテゴリーは、造影剤による腫瘍非検出患者で、造影剤で病変が認められない患者さんです。比較的悪性度の低いグリオーマの患者さんが多いのが特徴です。
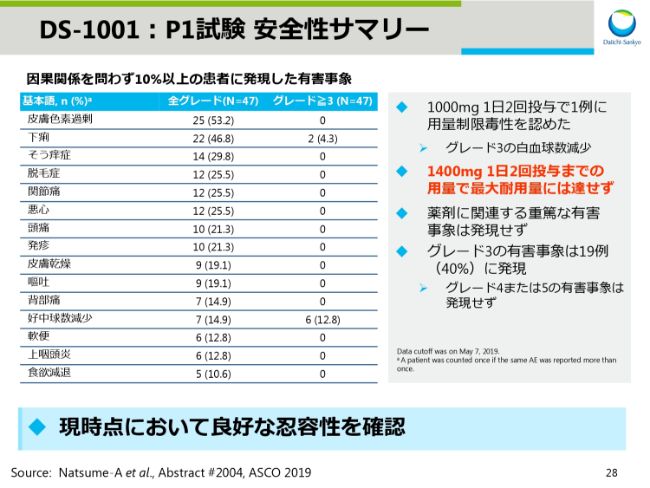
DS-1001:P1試験 安全性サマリー
スライド28は安全性のサマリーです。用量漸増Phaseで用量制限毒性は認められたものの、1400mg 1日2回に投与用量を上げても最大耐用量には達していません。
現時点において良好な忍容性が確認できています。
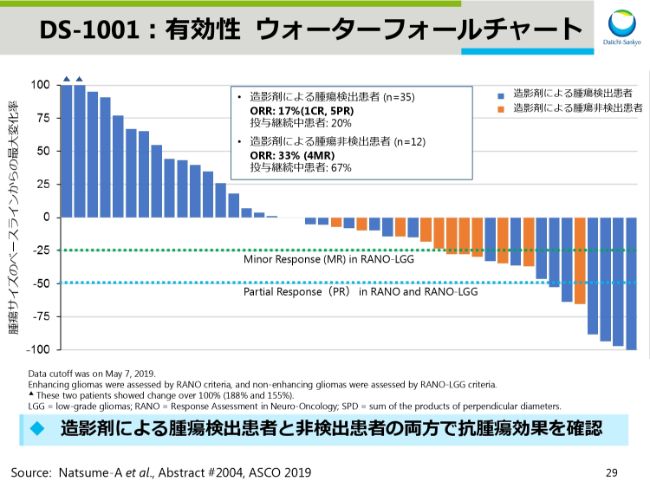
DS-1001:有効性 ウォーターフォールチャート
スライド29は、有効性を示すウォーターフォールチャートです。DS-1001は造影剤による腫瘍検出患者で奏効率(ORR)が17パーセント、非検出患者で33パーセントと両方で抗腫瘍効果が認められました。
ペキシダルチニブ:TGCTにおける有効性のアップデート
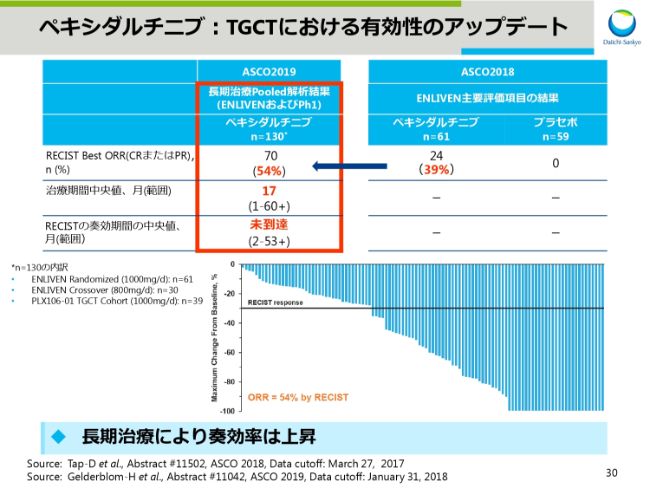
スライド30からは、ペキシダルチニブです。PhaseⅢ ENLIVEN試験の結果は2018年のASCOで発表しましたが、2019年のASCOでは長期投与による有効性と安全性の結果を発表しました。
本スライドは有効性の結果で昨年のASCOで発表したペキシダルチニブの奏効率が39パーセントであるのに対し、長期投与の結果、奏効率は54パーセントに上昇しました。
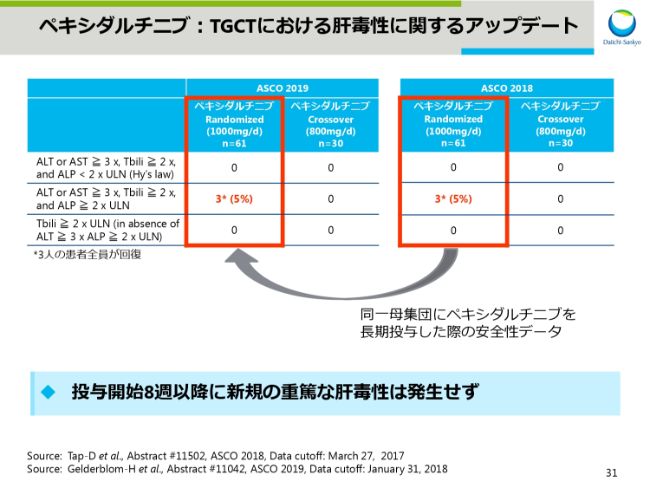
ペキシダルチニブ:TGCTにおける肝毒性に関するアップデート
スライド31は安全性のデータで、本剤の注意すべき有害事象である肝毒性に関し、投与開始8週以降に新規の重篤な肝毒性は発生しませんでした。
本剤はすでに米国と欧州で承認申請が受理されており、FDAの審査完了の定義PDUFA dateは8月3日であります。
直近のマイルストン
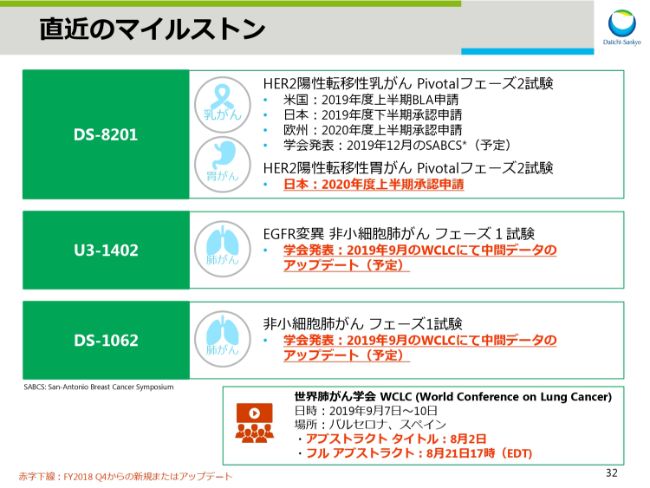
スライド32はADCフランチャイズの直近のマイルストンです。DS-8201の乳がんの申請準備は順調に進んでおります。胃がんに関しては2020年度上半期に日本で申請予定です。
U3-1402とDS-1062に関しては、9月にスペイン・バルセロナで開催される世界肺がん学会 WCLC(World Conference on Lung Cancer)にて発表を予定しております。発表が確定した際には弊社主催の説明会開催を考えております。
直近のマイルストン
スライド33は、AMLフランチャイズとブレイクスルーサイエンスの直近のマイルストンを示しています。
キザルチニブは6月18日に日本で承認を取得しました。米国では残念ながらコンプリート・レスポンスレター(CRL)を受領しました。CRLの内容を精査し、今後の対応を検討しています。
ペキシダルチニブはPhaseⅢ ENLIVEN試験の結果が「The Lancet」に掲載されました。米国での審査完了は8月3日を予定しております。
2019年度 R&D Dayのお知らせ
スライド34は、2019年度のR&D Dayのお知らせです。今年は初めて東京とニューヨークの2拠点で開催予定です。両日とも同じ内容を予定しております。
現在、アジェンダをいろいろと検討しているところですので、ぜひみなさま方、お楽しみにしていただければと思います。私からの発表は以上です。