2019年1月31日に行われた、大日本住友製薬株式会社2019年3月期第3四半期決算説明会の内容を書き起こしでお伝えします。IR資料
スピーカー:大日本住友製薬株式会社 代表取締役社長 野村博 氏
2019年3月期第3四半期決算説明会
野村博氏:みなさま、社長の野村でございます。決算の説明に先立ちまして、一言申し上げます。
本日(2019年1月31日)、「アポモルヒネ塩酸塩水和物」のComplete Response Letter(審査結果通知)の受領について、プレスリリースいたしました。Complete Response Letterにつきましては、昨年(2018年)8月の「dasotraline」に続くものでございます。
また、今週火曜日には、「SB623」のフェーズ2試験での主要項目が達成できなかったということもプレスリリースさせていただいております。弊社の開発活動においては、最善の努力をしたと考えておりますが、このような事態になりましたことは、私自身、誠に残念なことであり、責任を感じるところであります。
Complete Response Letterにつきましては、FDAのご指摘への対応について検討を続けたいと考えますし、「SB623」につきましては、データを詳細に分析の上、次のステップを考えたいと思います。
とくに、「SB623」は、私どもにとって細胞医薬の最初の試験ではありましたが、これによって、弊社の再生・細胞医薬事業の方針が影響を受けるものではございません。いずれにいたしましても、今後粘り強く進み方の検討を行うこととしたいと考えます。ご理解を賜りたく、よろしくお願い申し上げます。
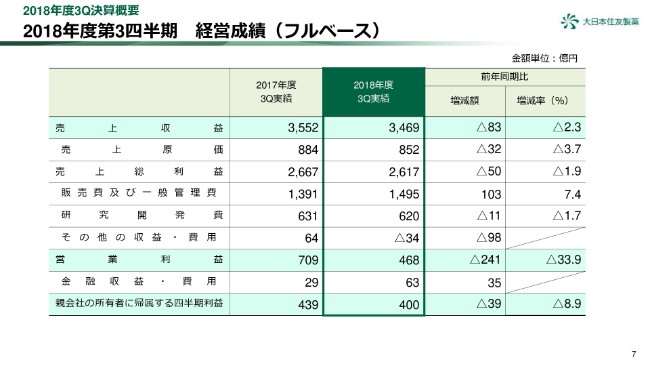
2018年度第3四半期 経営成績(コアベース)
加島久宜氏:加島でございます。それでは、プレゼン資料に基づき、2018年度第3四半期業績及び臨床開発の現況について、ご報告させていただきます。
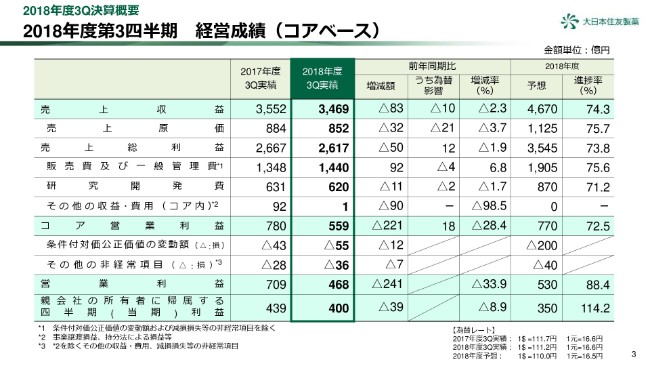
3ページをご覧ください。第3四半期累計の経営成績についてご報告いたします。
当第3四半期累計の業績は、前年同期比減収減益となりました。売上収益は、前年同期比で83億円、2.3パーセント減の3,469億円となりました。薬価改定や長期収載品の減少による、日本セグメントの減収が要因です。通期予想に対しては、ほぼ想定どおりの進捗です。
販売費及び一般管理費は、おもに北米セグメントで増加しましたが、通期予想に対してほぼ想定どおりに進捗しています。
研究開発費は、前年同期比でわずかに減少しています。
また、その他の収益・費用として、前年同期には北米における販売権の譲渡益約90億円が計上されており、この結果、コア営業利益は221億円減の559億円となりました。通期予想に対しては、やや低い進捗となりました。
条件付対価公正価値の変動額は、前年同期比での大きな変動はありませんが、「ロンハラ マグネア」の立ち上がりの遅れを織り込んだ販売計画に対し、当四半期において公正価値を見直した結果、費用が減少し、通期予想に対し低い進捗となっています。
この結果、営業利益は前年同期比241億円、33.9パーセント減の468億円となりました。
また、親会社株主に帰属する四半期利益は39億円、8.9パーセント減の400億円となりました。営業利益に比べ、減少額が小さくなっておりますが、前期は米国の税制改正の影響で一時的に税金費用が増加したことが要因です。
なお、当期の業績予想の修正はありませんが、あとのスライドで概要をご説明します。
主要製品売上収益(日本セグメント)
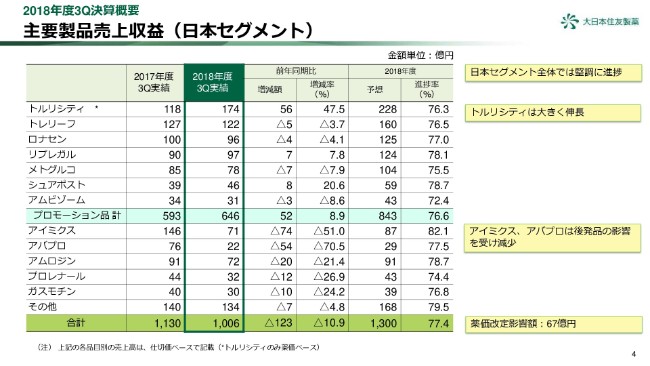
4ページは、日本セグメントの売上収益です。
日本セグメントの売上収益は、前年同期比123億円減少し、1,006億円となりました。薬価改定の影響が67億円あり、さらに後発品への切り替えが進む「アイミクス」、「アバプロ」が厳しい状況にあり、減収の要因となりました。
厳しい環境のなか、「トルリシティ」は引き続き大きく成長しており、「トレリーフ」は薬価改定の影響を数量増でカバー、さらに「リプレガル」「シュアポスト」も前年同期比で高い伸びとなり、健闘しました。
通期予想に対する進捗は77.4パーセントとなり、プロモーション品を中心に堅調に進捗しています。
主要製品売上収益(北米・中国セグメント)
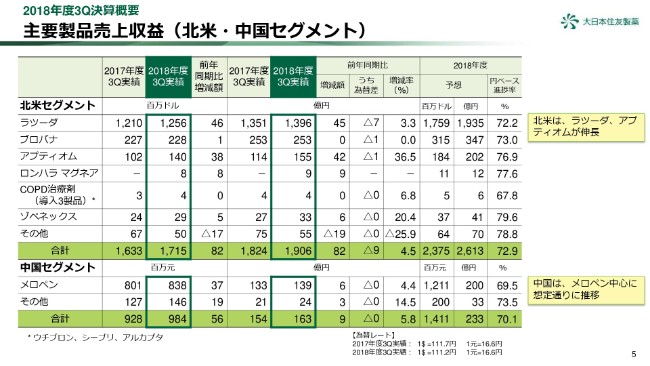
5ページをご覧ください。北米及び中国セグメントの売上収益について、ご報告いたします。
北米セグメントの売上収益は円ベースで1,906億円と、前年同期に比べ82億円、4.5パーセントの増収となりました。「ラツーダ」「アプティオム」の増収によるものです。
「ラツーダ」の売上は1,396億円で、前年同期比3.3パーセント増加しました。テレビCMなど、施策を拡充しておりますが、本年度前半の売上の伸びの停滞を挽回できておらず、予想に対してはやや遅れ気味の進捗です。
「アプティオム」は、計画どおりの進捗です。
中国セグメントは163億円で、前年同期を上回りました。「メロペン」を中心に、売上を伸ばしました。進捗はやや低めに見えますが、第4四半期は出荷が増加する見込みで、想定どおりの進捗と考えています。
なお、輸出などを含めた海外売上比率は、63.0パーセントとなりました。
セグメント別 経営成績(コアベース)
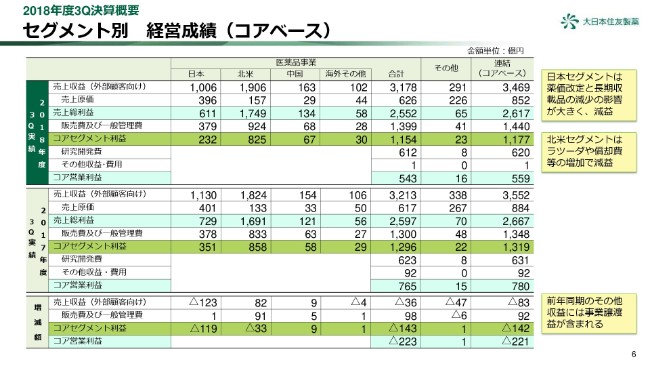
6ページをご覧ください。セグメント別の四半期経営成績をご報告いたします。
日本セグメントは大きく減収となったことが、コアセグメント利益に直接影響し、前年同期比119億円の減益となりました。
北米セグメントは増収となりましたが、同時に販売費及び一般管理費も増加しました。「ラツーダ」の広告費用や「ロンハラ マグネア」の特許権償却費、さらにANDA訴訟に関連する費用も増加しました。この結果、コアセグメント利益は、前年同期比33億円減の825億円となりました。
中国セグメントは、増収により、前年同期比9億円の増益となりました。
2018年度第3四半期 経営成績(フルベース)
7ページはIFRSのフルベースの業績ですが、説明は省略いたします。
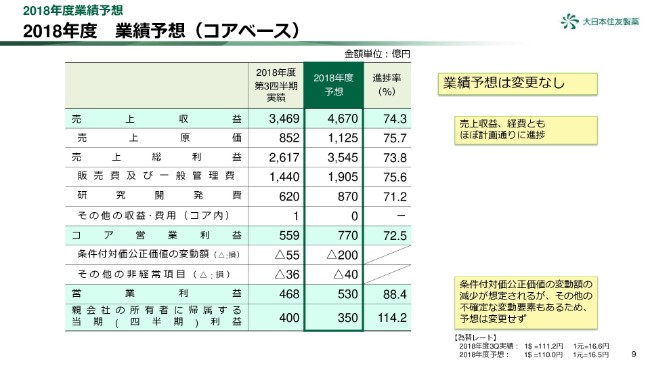
2018年度 業績予想(コアベース)
9ページをご覧ください。
業績予想につきましては、第3四半期決算まで、売上収益・経費ともにほぼ計画どおりに進捗しており、コア営業利益は少し低めの進捗ですが、予想は変えていません。
また、条件付対価公正価値の変動額についても進捗が低く、通期で費用の下振れの可能性がありますが、その他の不確定な変動要素もあるため、営業利益及び当期利益の予想は変更しておりません。
ラツーダANDA訴訟の状況
11ページは、「ラツーダ」のANDA訴訟の状況です。
2018年2月に提起した訴訟については、2018年12月に、本訴訟の被告16社すべてとの間で訴訟が終結しました。本訴訟の被告であった複数の後発品メーカーは、2023年2月20日以降に「ラツーダ」の後発品を販売することができます。
また、2018年8月から10月に追加で提起した3件のANDA訴訟については、2件が和解により終結し、残り1件のみが継続中です。
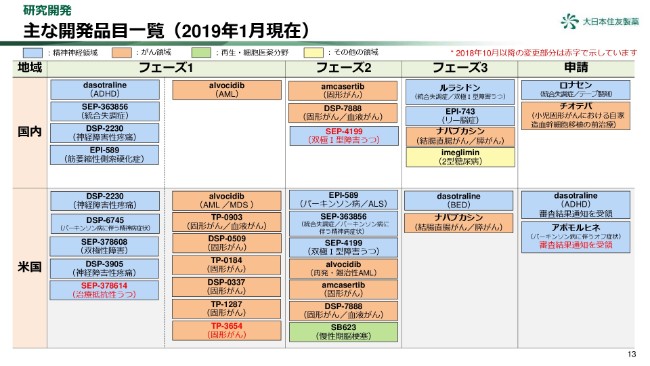
主な開発品目一覧(2019年1月現在)
13ページをご覧ください。ここからは、開発状況に関してご報告いたします。
この表は、当社の開発品目の開発段階の一覧表です。(2018年)10月からの変更点につきましては赤字で示しており、次のページでご説明いたします。
臨床開発の進捗状況(2018年10月30日からの主な変更点)①
14ページをご覧ください。精神・神経領域について、(2018年)10月からの変更点をまとめています。
「ルラシドン」については、中国において本年(2019年)1月に承認を取得し、2019年度上市予定です。また、日本において、統合失調症のフェーズ3試験の良好なトップライン結果を得られました。
「アポモルヒネ」について、FDAからComplete Response Letterを受領しました。今後、FDAとの協議を踏まえて、早急に対応する予定です。
「SEP-363856」については、米国において、統合失調症のフェーズ2試験の良好なトップライン結果が得られました。
「SEP-4199」については、米国で実施しているフェーズ2試験に、日本も参加いたしました。
「SEP-378614」は、PsychoGenics社の「SmartCube®」システムを利用し、見出された中枢神経系に作用する化合物です。米国において、フェーズ1試験を開始しました。
臨床開発の進捗状況(2018年10月30日からの主な変更点)②
15ページをご覧ください。
がん領域では、「TP-3654」に関して、米国において固形がんのフェーズ1試験を開始しました。「TP-3654」は、PIMキナーゼ阻害を介して、炎症性シグナル経路を抑制する化合物です。
再生・細胞医薬では、「SB623」に関して、慢性期脳梗塞のフェーズ2試験について、主要評価項目を達成しませんでした。現在、詳細結果を解析中です。
また、「DSP-6952」については、期待される有効性が得られなかったため、開発を中止することにしました。
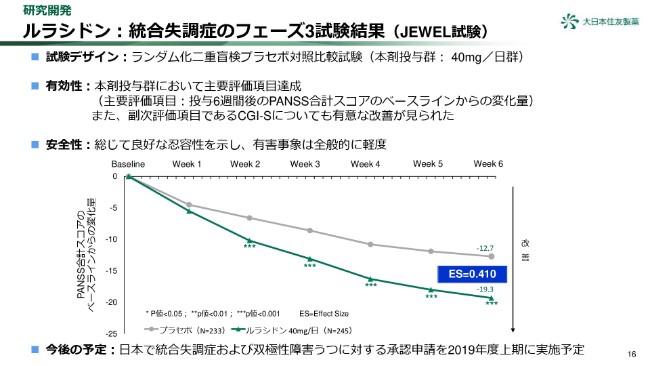
ルラシドン:統合失調症のフェーズ3試験結果(JEWEL試験)
16ページをご覧ください。「ルラシドン」の日本での統合失調症患者を対象としたフェーズ3試験の結果をまとめています。本試験結果の速報は、(2019年)1月10日にプレスリリースにて公表しております。
有効性については主要評価項目を達成し、副次評価項目であるCGI-Sについても、有意な改善が見られました。本試験の結果と、すでに終了した双極性Ⅰ型障害うつを対象としたフェーズ3試験の結果に基づき、2019年度上期に日本において統合失調症及び双極性障害うつに対する承認申請を実施する予定です。
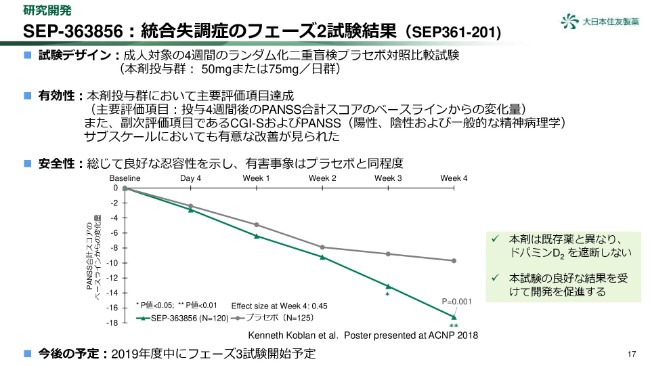
SEP-363856:統合失調症のフェーズ2試験結果(SEP361-201)
17ページをご覧ください。「SEP-363856」の成人統合失調症の患者を対象としたフェーズ2試験の結果をまとめています。本試験結果は、昨年(2018年)12月の米国精神・神経薬理学会(ACNP)にて、発表しております。
本剤は、既存薬と異なり、ドパミンD2を遮断しない化合物です。有効性については、主要評価項目を達成し、副次評価項目であるCGI-S及びPANSSサブスケールでも改善が見られました。
安全性については、総じて良好な忍容性を示し、錐体外路症状を含む有害事象は、「プラセボ」と同程度でした。本試験の良好な結果を受けて、本剤の開発を促進いたします。2019年度中にフェーズ3試験を開始する予定です。
以上で説明を終わります。