2023年3月29日に行われた、オンコリスバイオファーマ株式会社事業説明会の内容を書き起こしでお伝えします。
スピーカー:オンコリスバイオファーマ株式会社 代表取締役社長 浦田泰生 氏
オンコリスバイオファーマ株式会社 取締役 吉村圭司 氏
オンコリスバイオファーマ株式会社 取締役 樫原康成 氏
オンコリスバイオファーマ株式会社 社外取締役 斎藤泰 氏
オンコリスバイオファーマ株式会社 社外取締役 飯野直子 氏
オンコリスバイオファーマ株式会社 執行役員 磯山修一 氏
オンコリスバイオファーマ株式会社 執行役員 田口めぐみ 氏
オンコリスバイオファーマ株式会社 執行役員 秦耕平 氏
オンコリスバイオファーマ株式会社 執行役員 吹野晃一 氏
オンコリスバイオファーマ株式会社 執行役員 米尾哲治 氏
事業説明会
浦田泰生氏(以下、浦田):本日はご多忙にもかかわらず、事業説明会にご参加いただき、誠にありがとうございます。事業説明会の前に、当社各部門の執行・ガバナンス体制を担うメンバーよりご挨拶いたします。
磯山修一氏:事業開発担当の磯山でございます。当社は、腫瘍溶解ウイルス「テロメライシン」の製造販売業許可を取るため、全社一丸となって進んでおります。事業開発では、他社との提携や協業の契約等を締結することにより、「テロメライシン(OBP-301)」の製品価値や企業価値の最大化を目指し、日々努力を重ねていきます。今後ともどうぞよろしくお願いいたします。
田口めぐみ氏:人事担当執行役員を拝命いたしました、田口めぐみでございます。昨年は、製造販売体制の事業拡大という事業戦略のもと、薬事戦略部や品質管理企画室といった機能を新たに設置しました。それに伴い、PMDA(医薬品医療機器総合機構)の経験者や知見豊かな方に入社していただきました。
今後も製造体制及び業許可申請に伴う三役の採用などを進めていきます。また、新しい機能や人材が加わる中で、特に今年は縦横の連携を強め、私自身もギアをさらに上げて、邁進していきたいと思っています。今後ともご支援のほどよろしくお願いします。
秦耕平氏:事業企画を担当している執行役員の秦でございます。当社は今年12月で株式の上場から丸10年を迎え、1つの節目になると考えています。株主のみなさまのご期待に報えるよう、励んでいきたいと思っています。2024年の「テロメライシン」の承認申請に向けた当社の活動に、引き続きご支援いただければと思います。どうぞよろしくお願いいたします。
吹野晃一氏:研究開発担当執行役員の吹野でございます。当社の研究開発チームは、「テロメライシン」を最重点項目とし、日々申請準備に励んでいます。「テロメライシン」を1日も早く臨床現場にお届けして患者さまの健康に貢献し、株主のみなさまのご期待に応えられるよう、研究開発チーム一同、一丸となって邁進していきます。
米尾哲治氏:経理財務担当執行役員の米尾でございます。今後、会社は重要な局面を迎えますが、経理財務部門としては、みなさまに信頼いただけるような会計情報を引き続き提供していきたいと思っています。どうぞよろしくお願いいたします。
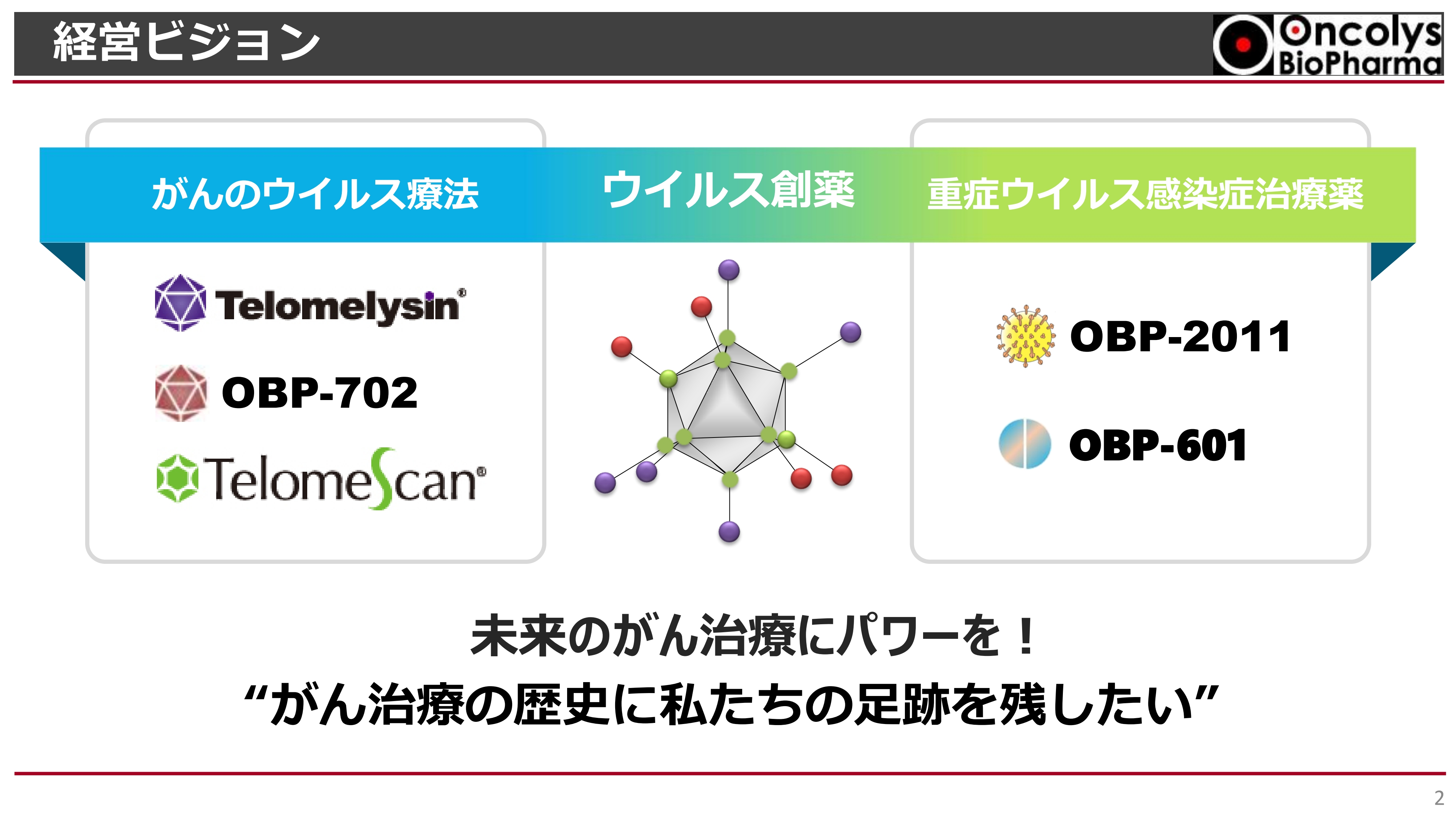
経営ビジョン
浦田:事業説明会を始めます。当社は、がんのウイルス療法や重症ウイルス感染症治療薬などをターゲットにしている創薬ベンチャーです。
未来のがん治療にパワーを与え、当社が成し遂げた仕事が医療の歴史に足跡として残るように取り組んでいきたいと考えています。決して開発だけではなく、「実際に医薬品としてみなさまに使っていただける状況までもっていきたい」という思いを持っています。
また、当社はこのビジョンにあえて「ウイルス創薬」という名前をつけています。このようなウイルス創薬に取り組んでいる会社は世界でもまれで、当社は非常に特徴のあるパイプラインを持っています。
そして、「テロメライシン」や「テロメライシン」の第2世代である「OBP-702」を開発しており、第3世代のウイルスもすでに設計することができています。
重症ウイルス感染症治療薬については、「OBP-2011」という新型コロナウイルスの治療薬の開発からスタートしました。今後はもう少し幅広いウイルス治療薬として開発できないかと探索している状況です。
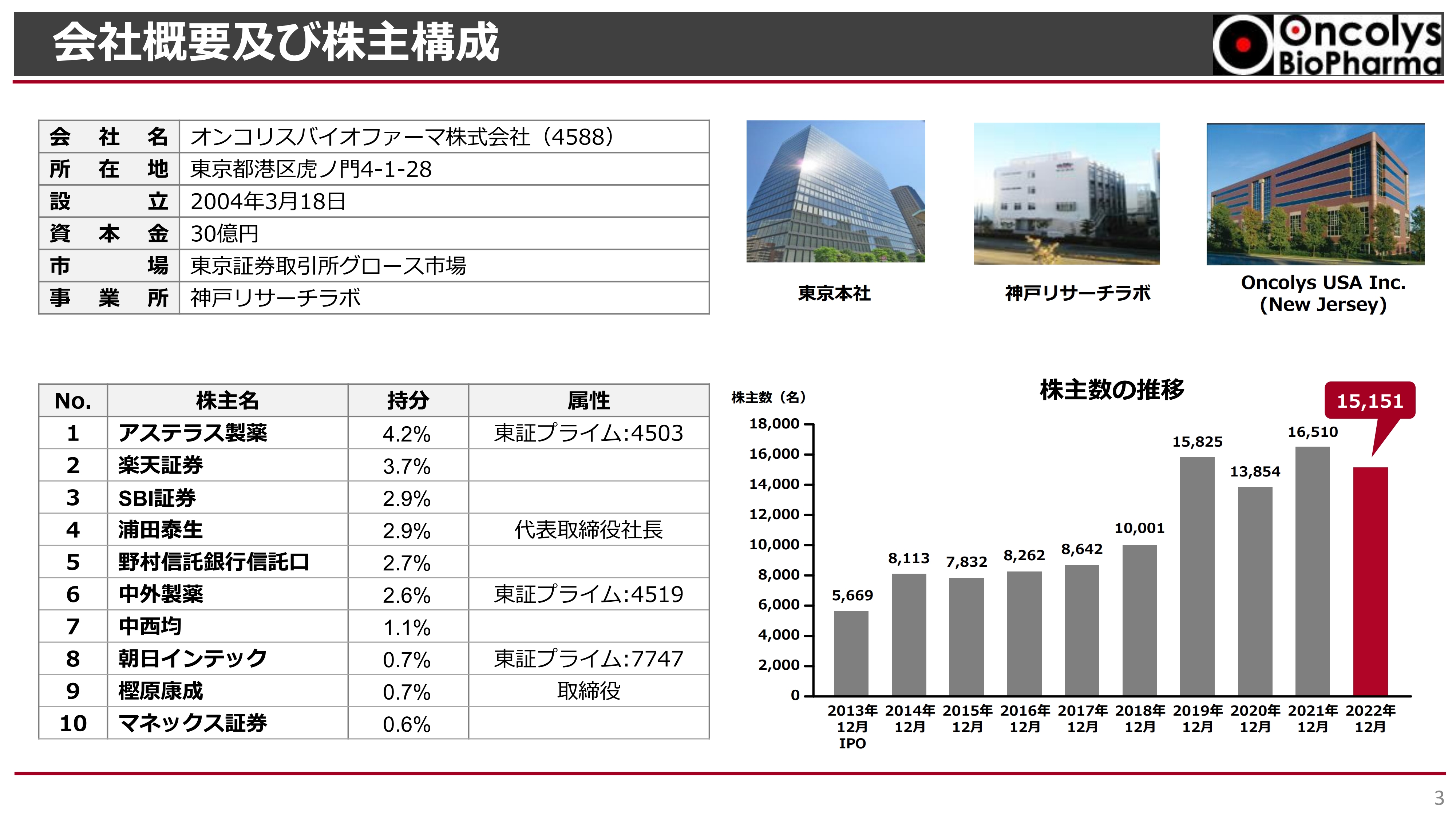
会社概要及び株主構成
会社概要及び株主構成です。東京の虎ノ門に本社があります。それ以外には、神戸リサーチラボが兵庫県神戸市のポートアイランドの中にあり、ウイルスの製造や開発、品質管理試験の開発を行っています。
右上の写真は、アメリカにあるOncolys USAです。小さなオフィスですが、ここで臨床試験やビジネス活動を行っています。
なお、筆頭株主はアステラス製薬で、現在その他に約1万5,000名の株主がいます。
グローバルネットワーク
現在のグローバルネットワークです。スライド中央の写真は、岡山大学消化器外科学の藤原俊義教授で、私はこの方と一緒に会社を作りました。
左側の写真は鹿児島大学で理事を務める馬場昌範教授で、ウイルス感染治療薬を共同で開発してきました。
右側の写真はOncolys USA社長のTalia Biranです。さまざまな大手製薬メーカーの開発部長を歴任し、アメリカにおいて医師や研究施設等との非常に強いネットワークも持っています。
続いて、アステラス製薬は筆頭株主です。また、大株主でもある朝日インテックはカテーテルの会社です。食道がん治療薬として開発している「テロメライシン」を、医療従事者のニーズをヒアリングしながら、投与しやすい新しいデバイスをともに作っていければと考えています。
左下は台湾のメディジェン社で、こちらも創業早期から「テロメライシン」の開発に対して、コストシェア・プロフィットシェアを行っている会社です。
左端はベルギーにあるヘノジェン社で、現在「テロメライシン」の製造を行っています。こちらでGMP製造や商用製造まで進めていきたいと考えています。
アメリカにもたくさんのネットワークがありますが、主に臨床施設です。下から2つ目のTransposon社は、当社の「OBP-601」を、神経難病領域で開発するために設立された会社です。
それ以外にも、現在「テロメライシン」の最終試験としてPhase2の試験を行っている臨床施設や研究会等、いろいろな組織があります。なお、臨床施設は北海道から九州まで合わせて17施設あります。
ガバナンス体制
当社のガバナンス体制です。
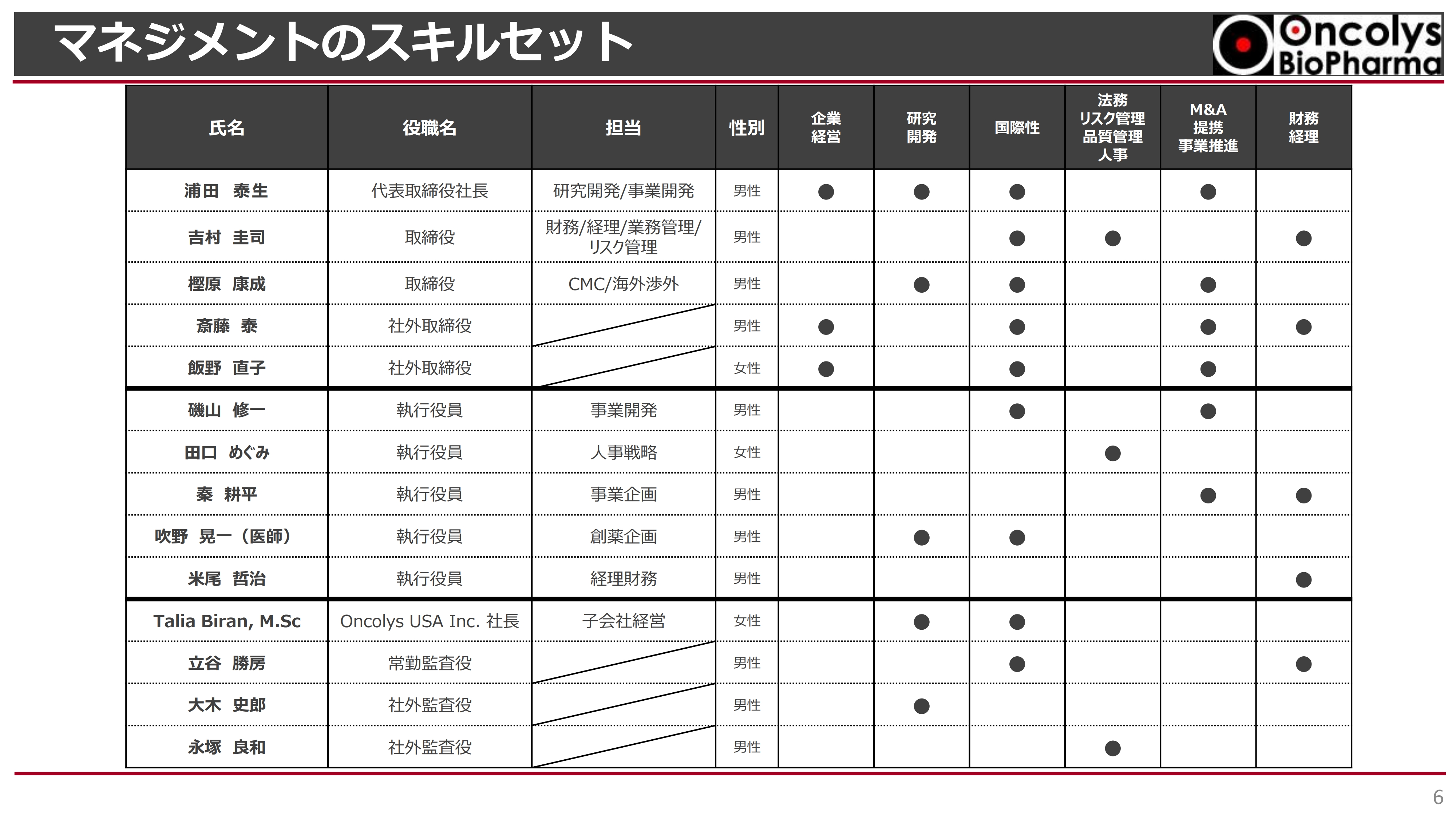
マネジメントのスキルセット
マネジメントのスキルセットです。企業経営や研究開発、国際性、法務・リスク管理・品質管理・人事、M&A・提携・事業推進など、非常に多様な能力を持った人材が集まり、会社を経営しています。
今回は新たに女性の取締役が株主総会で承認されており、執行役員の中にも女性が1人います。今後も可能な限り、多様性のある経営体制を整えていきたいと考えています。
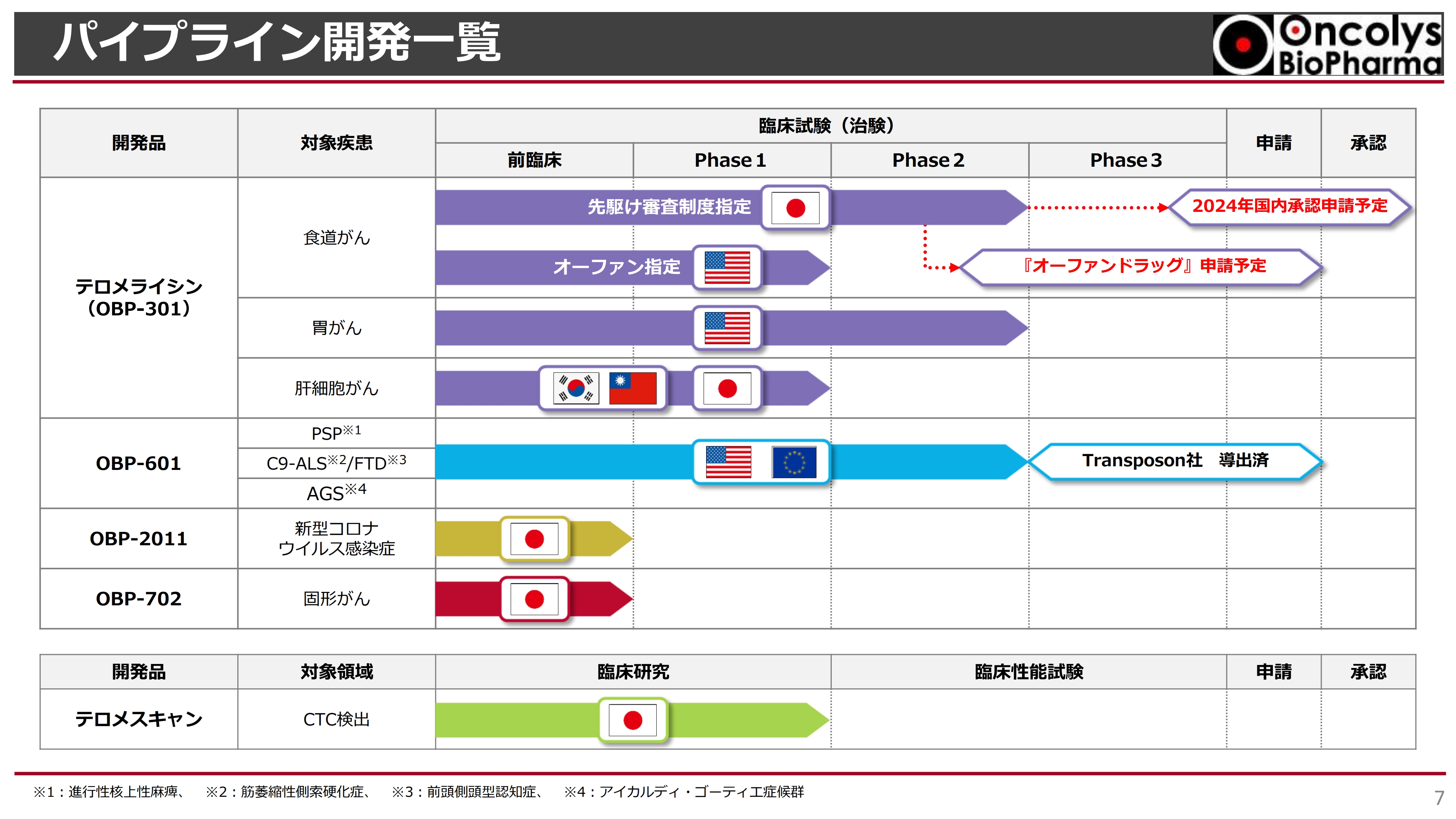
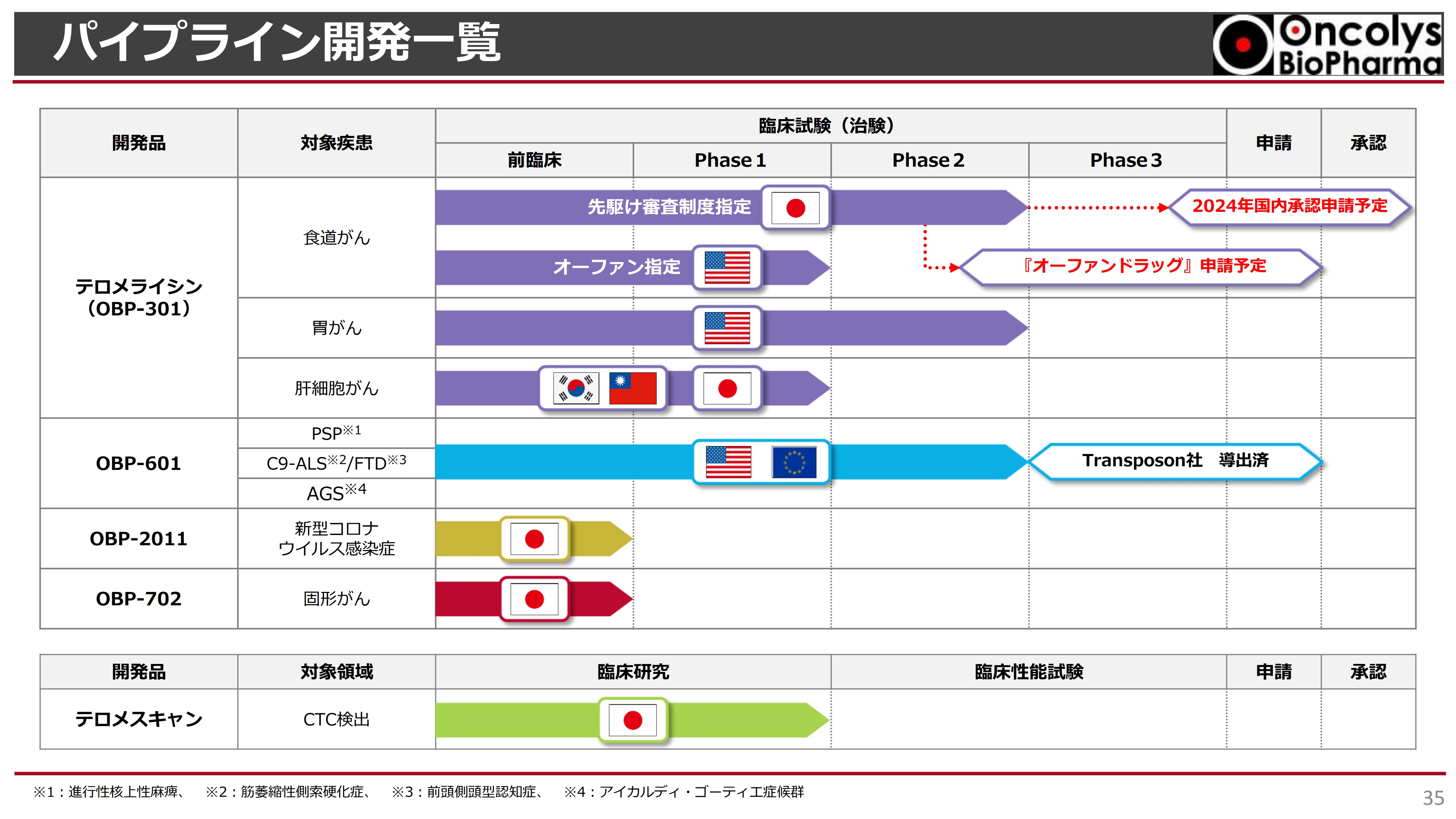
パイプライン開発一覧
パイプラインの一覧表です。スライドの表の一番上が「テロメライシン」で、食道がんが最も開発が先行しています。現在、先駆け審査制度指定を受け、Phase2の最終段階であるフォローアップまで来ており、2024年度に承認申請まで進めたいと考えています。
そのためにも、承認申請の前に「オーファンドラッグ」申請を行い、希少な疾患に対する薬であるというお墨付きをいただきたいと考えています。アメリカではすでに食道がんがオーファン指定を受けていますが、米国での食道がん試験はまだPhase1の段階です。
胃がんの臨床試験は、Phase2の最初の段階を行ったところです。次の段階については後ほどお話しします。
上から2つ目に記載している「OBP-601」については、Transposon社が非常に難しい神経疾患に適応できないかと、現在アメリカで臨床試験を行っています。
テロメライシン(OBP-301) suratadenotrev
「テロメライシン」の状況をお伝えしてきました。スライドに記載しているとおり、当社はできるかぎり「がんを切らずに治療する」という夢を標榜しています。
テロメライシンとは
「テロメライシン」は腫瘍溶解性ウイルス治療薬です。アデノウイルスは、風邪を引いた際に扁桃腺の腫れを起こすウイルスで、テロメライシンは、このアデノウイルスの遺伝子を改変し、がん細胞だけでスイッチが入るような構造になっています。
正常細胞では感染するものの、スイッチが入らないため普通の新陳代謝でウイルスは消えてなくなるメカニズムで、がん細胞だけを溶解する、あるいは殺してしまうウイルスです。
現在は食道がんを第1ターゲットとしています。特に食道がんではものが飲み込めない状況にもなり得ますが、局所で作用するため、これらを解消できる可能性があります。
この「テロメライシン」が承認されると、世界で初めての食道がんの局所治療薬となり、なおかつアデノウイルス製剤として先進国で初めての上市になると思います。
これまでの臨床試験の結果では、「テロメライシン」を注射すると、約2日にわたって37度から38度の熱が出ましたが、「カロナール」など解熱鎮痛薬を飲めば治ります。化学療法のような、強烈な吐き気や脱毛、強い貧血などがほとんど起こっていないところが特徴です。
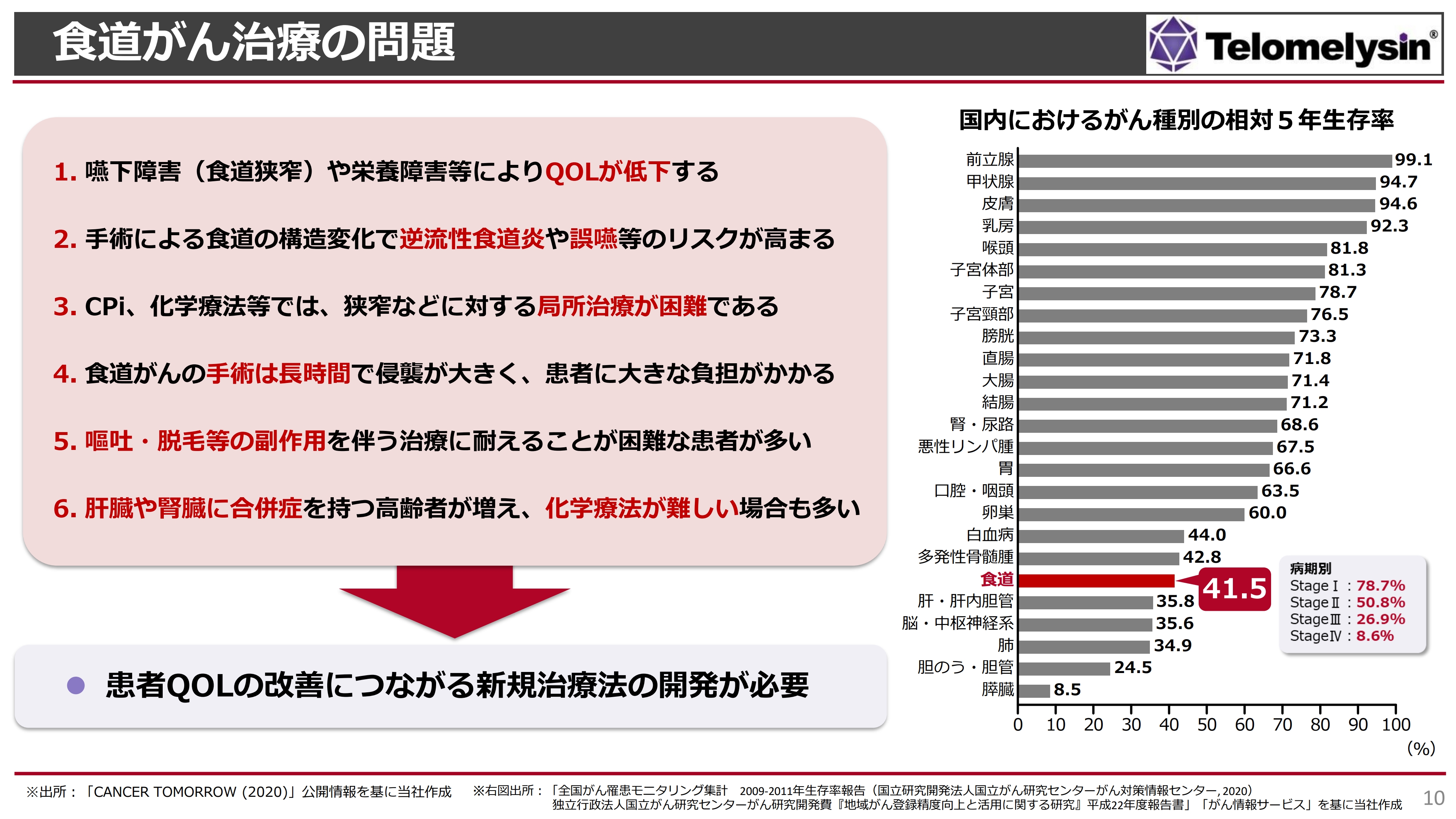
食道がん治療の問題
右に記載しているのは、国立がん研究センターが出している2020年の国内におけるがん種別相対5年生存率です。前立腺がんや甲状腺がんは90パーセント以上の5年生存率を示していますが、依然として食道がんは下から6番目となっており、5年生存率が非常に低い疾患として認知されています。
先ほどお伝えしたとおり、食道がんになると、ものが飲み込めず、食べられません。手術も8時間から10時間と非常に長くなるため、心臓の弱い方や高齢の方にはとても耐えられません。
また、手術しても40パーセントくらいの方が、術後に腎臓障害や肝臓障害、脳障害といった合併症を発症すると言われています。特に高齢の方や、腎臓・肝臓が弱い方は、化学療法などが受けられないデメリットもあります。
このような食道がんの問題に対して、当社は「テロメライシン」を食道がんの局所に注射することによって、QOL(Quality Of Life)を上げるばかりではなく、手術しなくてもよい状況までもっていくという目標を掲げ、臨床試験を進めてきました。
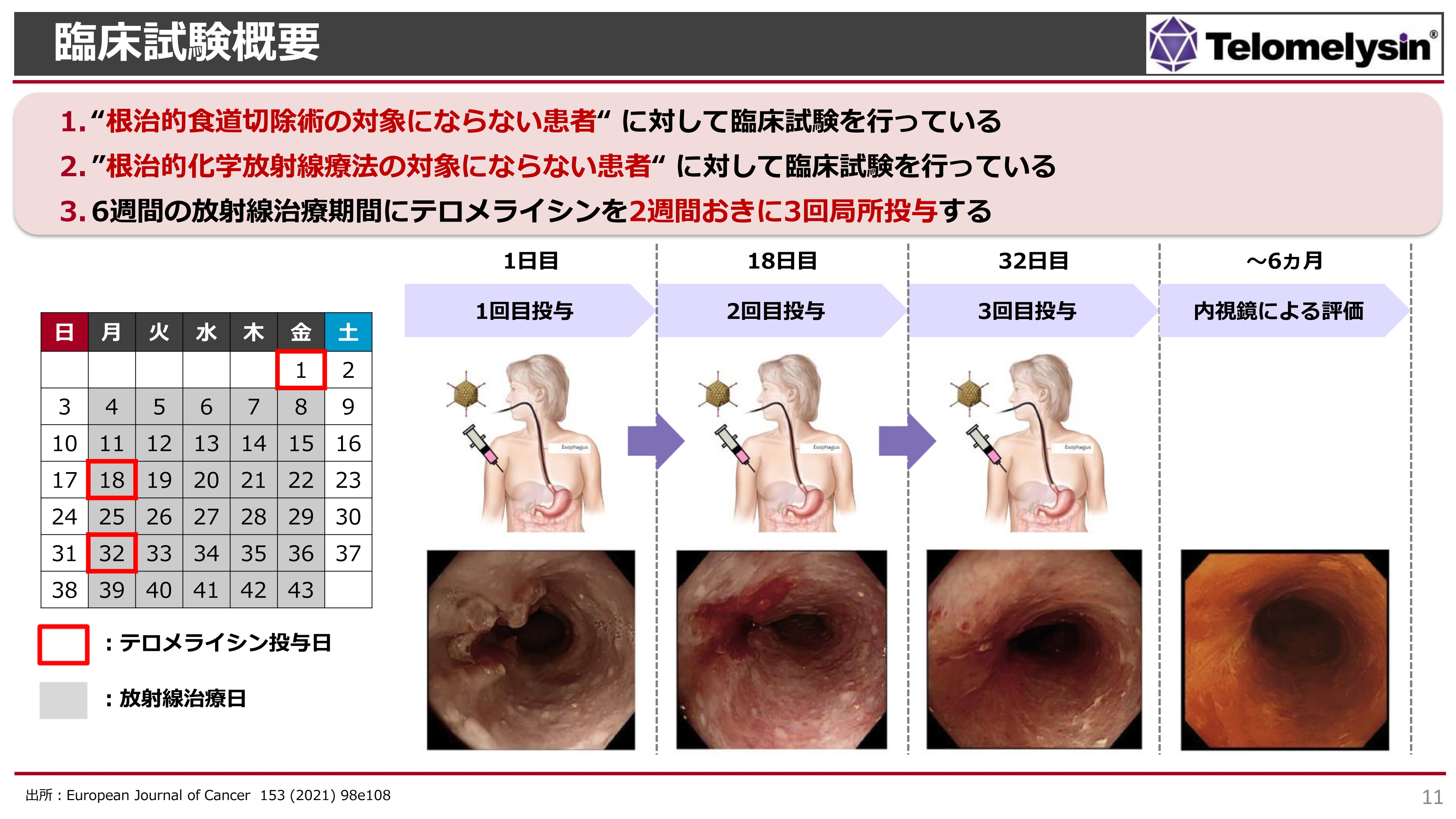
臨床試験概要
臨床試験の概要です。スライド左側のカレンダーでは、月曜日から金曜日までをグレーに塗り潰していますが、このように毎日患部に放射線を少量ずつ当てる治療を6週間続けます。痛くもかゆくもありませんが、放射線単独治療の治癒率はそれほど高くなく、放射線照射による食道炎などの合併症が起こりやすいデメリットもあります。
「テロメライシン」は、この放射線治療と併用して投与します。例えば、放射線治療を始める前の金曜日、2週間後の月曜日、さらに2週間後の月曜日の3回にわたり、内視鏡を使い食道がんの局所に投与します。
その後、6ヶ月以内に内視鏡によるフォローアップの評価を行っていきますが、3回目の投与の段階でがんが消え、どこにあったのかわからなくなるほど効果が出ている症例もあります。
スライドの写真は、岡山大学における臨床研究の症例です。消化管の内視鏡の写真ですが、3ヶ月後には、ほとんどがんが消えています。
症例によっては、どの臨床医も「放射線治療だけではとても治療ができない」と言うところ、「テロメライシン」と併用することにより、3回目の治療ではがんが消えて、食事もとれるようになったという治癒例もあります。このような結果をもとにして、国内の臨床試験を始めています。
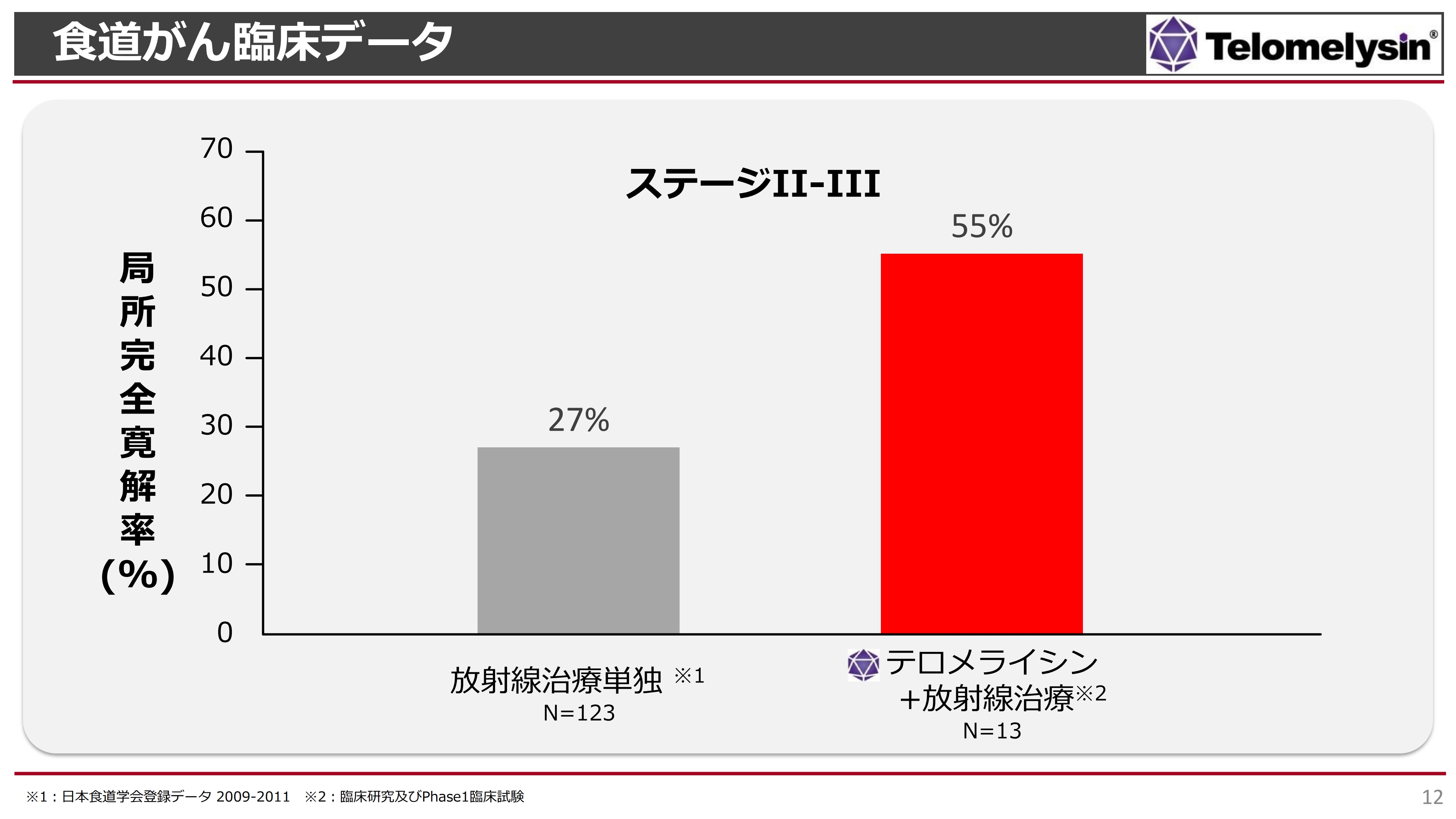
食道がん 臨床データ
食道がんのStageⅡ及びStageⅢにおける臨床データです。左側の棒グラフが放射線治療単独、右側の棒グラフが岡山大学の臨床研究及び当社が実施したPhase1臨床試験の結果です。「テロメライシン+放射線治療」は、「放射線治療単独」と比較して概ねダブルスコアとなっています。
直接比較した試験ではなく、別々の集計ですが、放射線単独では約30パーセントしか局所のがんが消えなかったにもかかわらず、「テロメライシン」を上乗せすると、55パーセントの局所のがんが完全に消えたという結果になります。この結果をもとに、日本国内の17施設で臨床試験を行ってきました。
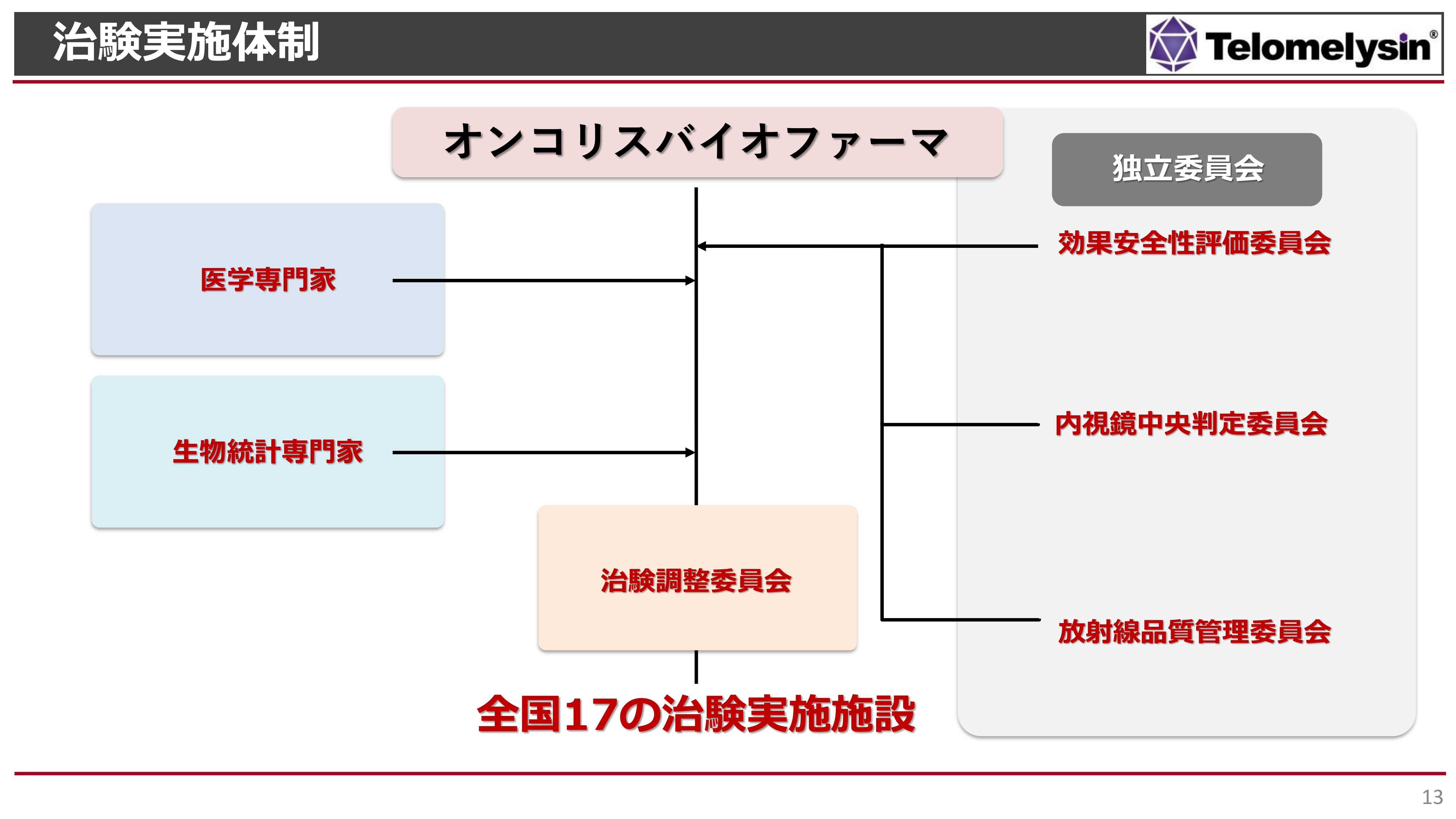
治験実施体制
現在の治験体制です。左側には医学専門家や生物統計専門家がいます。治験調整委員会があり、全国17の治験施設で行ってきました。
それ以外にも、右側に記載しているとおり、独立委員会という重要な委員会もあります。試験データを客観的に評価していただくために設けた委員会で、効果安全性評価委員会には食道学会の先生にも参加いただいています。
内視鏡による治療判定は、治療薬の有効性の非常に重要なキーとなるポイントであり、複数の先生に内視鏡で治療判定を行っていただいています。
また、放射線が正しく当たっているかどうかを評価するために、放射線品質管理委員会と提携し、より臨床試験の質を高める体制を構築しています。
年内には内視鏡の判定や生存率の結果が出るため、その結果をトップラインにして、みなさまにしっかりとご報告したいと考えています。
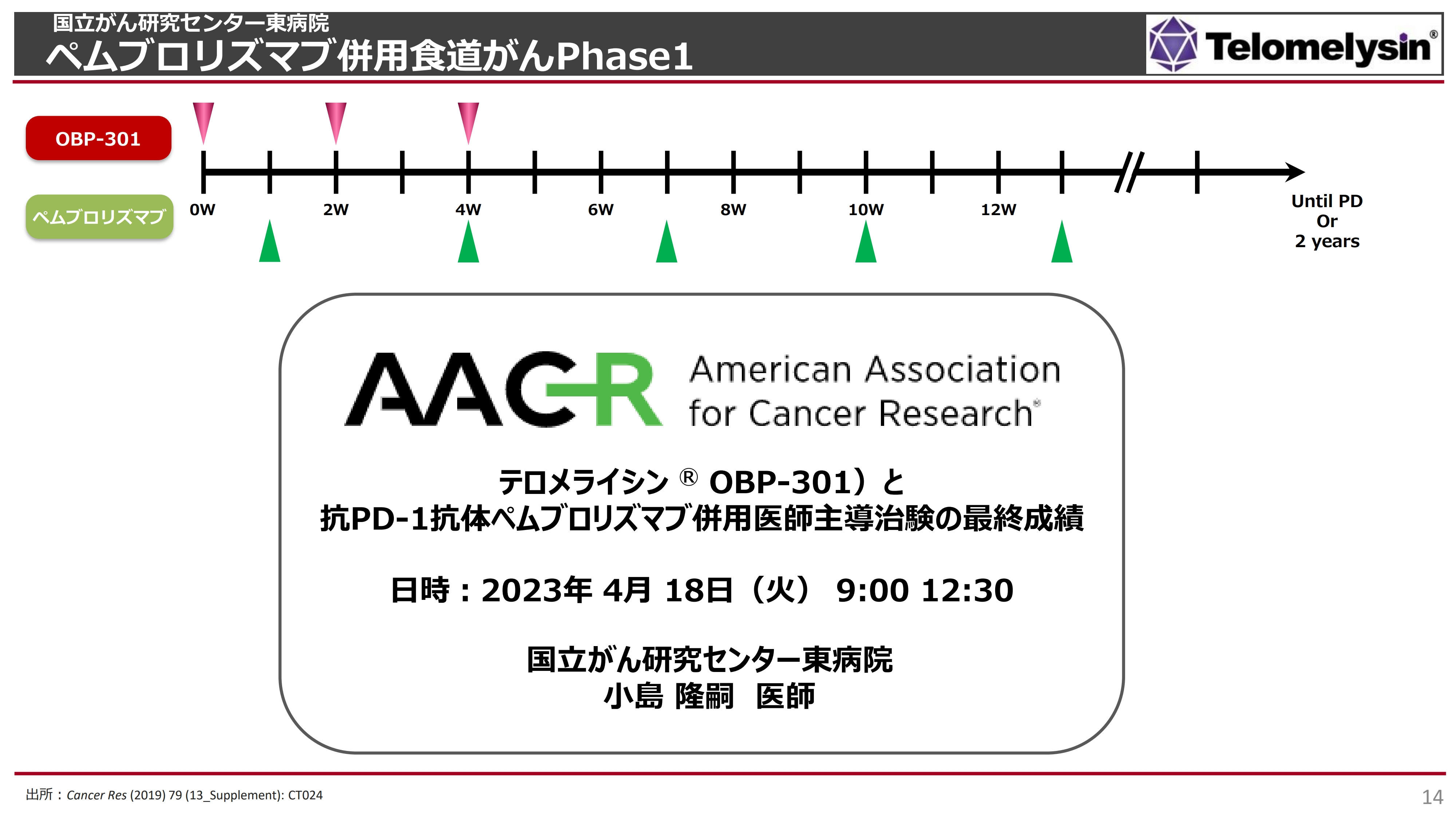
国立がん研究センター東病院 ペムブロリズマブ併用食道がんPhase1
先日ご報告した、国立がん研究センター東病院で行われた「ペムブロリズマブ」併用食道がんPhase1についてです。スライドには「食道がん」と記載していますが、実際には各種固形がんを対象にしたPhase1の臨床試験となります。
このPhase1では、初めて「テロメライシン」と「ペムブロリズマブ」というチェックポイント阻害剤を併用し、安全性を確認する目的で試験を始めました。
2023年3月22日のIRでもお伝えしたとおり、パーシャルレスポンス(部分奏効)として2例ご報告しました。こちらは全体の9.1パーセントで、「よいのか、悪いのか?」とたくさんのご質問をいただきましたが、確かにそれほど高い数字ではありません。
昨年もご報告したとおり、最初は9例のうち3例でレスポンダーが出ていましたが、その3例のうち1例については、がんが大幅に縮小するという効果が出ていたものの、別の臓器に転移が見つかり、この段階で部分奏効から外されました。そのため、規定上、残りの2例が部分奏効を示したと報告せざるを得ませんでした。
こちらの臨床試験は全部で22例ありますが、対象は放射線や化学療法、手術などいろいろな治療を3回以上受けた方です。また、「ニボルマブ」などのチェックポイント阻害剤も投与したものの、まったく効かなかったという非常に重い症例で実施されたということを前提として考えなければなりません。
この22例中18例が食道がんでした。結論としては、こちらの試験でも重篤な副作用は認められなかったため、Phase1としての目標は1つ達成できました。
有効性について、今後、バイオマーカーを基に症例を選択していくことで、より良い有効性データが出てくるかもしれませんが、そのあたりは実際に取り組んでみなければわかりません。
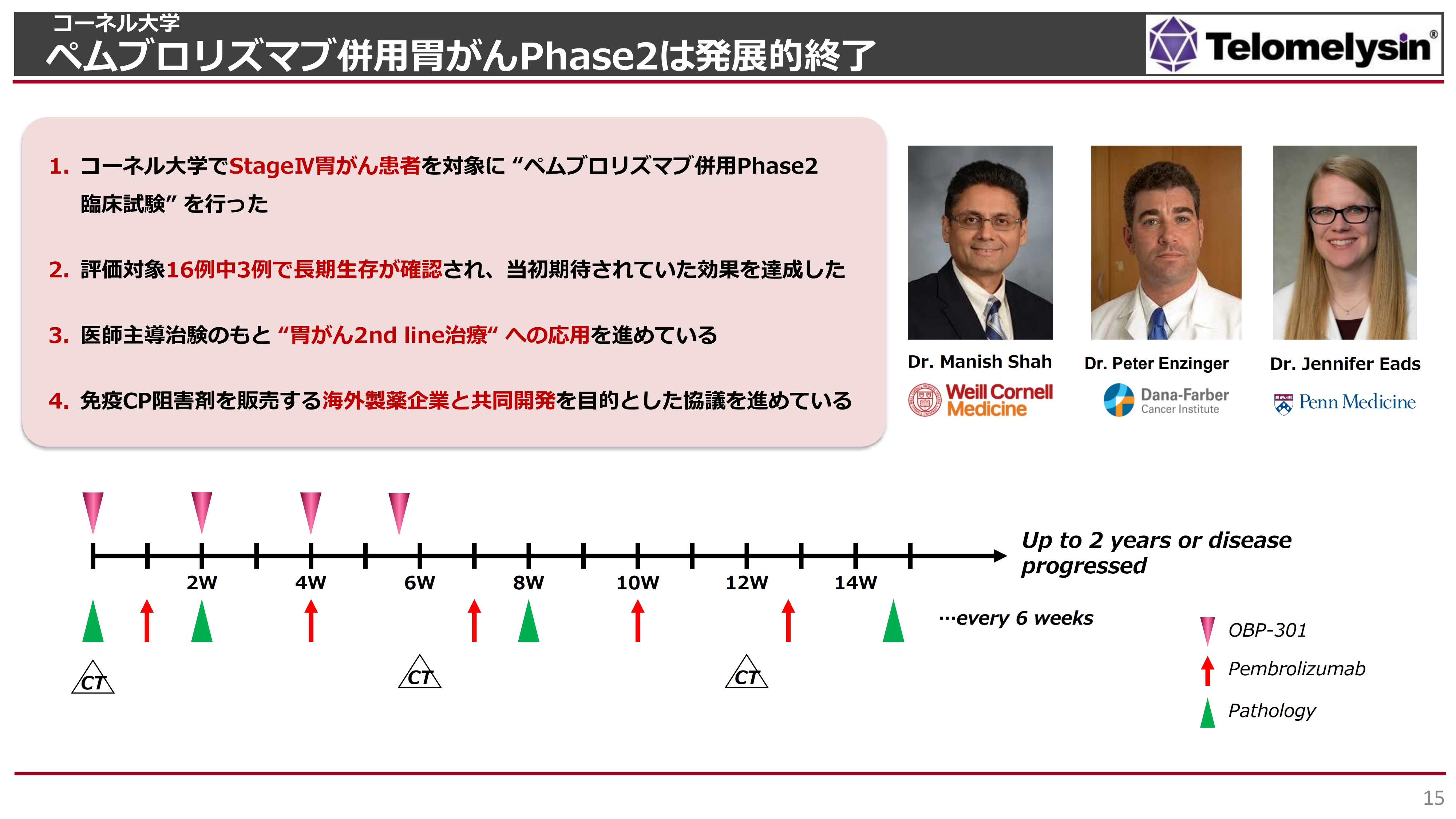
コーネル大学 ペムブロリズマブ併用胃がんPhase2は発展的終了
浦田:もう1つ、2023年3月22日のプレスリリース公表後、現在アメリカのコーネル大学で行われている胃がんの臨床試験に関して、「免疫チェックポイント阻害剤を販売している製薬企業との共同開発契約協議にネガティブなインパクトを与えるのではないか?」というご質問もありました。
アメリカでの臨床試験は胃がんであり、日本国内は食道がんのため、がんの種類が異なります。
しかし、彼らも日本の臨床試験の結果は重視しています。特に、安全性を気にしていたため、その点は彼らにとってはプラスに働いたと考えています。
このコーネル大学を中心に行っている胃がんの臨床試験はPhase2のため、「安全性はすでに日本国内である程度見えてきたので、有効性を十分に見ていきましょう」という治験になっています。
スライドに記載のとおり、全部で16例エントリーしました。すべてStageⅣの胃がんで、長期生存が難しい患者さまが多かったものの、このうち3例で長期生存が確認されています。
これまでのチェックポイント阻害剤の臨床試験で、「ペムブロリズマブ」と化学療法を併用した長期生存率は15パーセントから20パーセントくらいでした。それを考えると、「ペムブロリズマブ」と「テロメライシン」で、20パーセント弱という結果は「目標を達成した」と、Dr. Manish Shahは語っています。
臨床試験では「ペムブロリズマブ」と「テロメライシン」だけを併用していましたが、現在アメリカではすでに、特にStageⅣ胃がんの方に対しては「ペムブロリズマブ」と化学療法を併用しないと保険がおりない状況になっています。
そのような意味で、すでに「ペムブロリズマブ」と「テロメライシン」だけというこの臨床試験は、非常に続けにくい状況になってきています。
しかし、今回アメリカで行った臨床試験でもごく少数例ですが、これまで「ペムブロリズマブ」が効かなかった人が「テロメライシン」を投与することによって、「ペムブロリズマブ」との併用効果で、胃がんがぐっと小さくなったという症例が見られました。
この結果から、「テロメライシン」は「ペムブロリズマブ」に抵抗するような症例に対して、その抵抗力を排除する作用があるのではないかと、コーネル大学医科の研究施設の先生方は考えています。
現在、アメリカ合衆国でも「1回治療したが効果があまりなかったので、次の治療をしましょう。それでは、どのようなレジュメで治療しますか?」というセカンドラインが、胃がんにおいては定まっていません。
これに対してコーネル大学は、「ペムブロリズマブ」と化学療法を併用した場合、約8割の患者さまには効かないため、この方々を対象に今度は「ペムブロリズマブ」に「テロメライシン」を上乗せすると、もう1回効果が戻るのではないかというセカンドライン治療の臨床試験計画を打ち出しました。
詳しいご説明は控えますが、チェックポイント阻害剤を販売しているアメリカの大手製薬企業と討議したところ、「その考え方は非常におもしろい」ということになりました。
そこでその会社と、そのプロトコルの詳細を検討し、納得できるものであれば「ある意味の共同開発体制にシフトしましょう」と言われています。すでにその会社に新しい臨床試験の計画を出しており、現在その会社内で評価が進められています。
これがうまくいくと、共同開発契約ということになると考えています。臨床試験は非常にお金がかかるため、どこかの会社と組まなければ、せっかくそれなりの結果が出た胃がんに対する効果検証も終わってしまいます。
したがって、製薬会社と組めるよう善処し、この臨床試験の次の段階であるセカンドラインでの治療を目指し、開発を進めていきたいと考えています。また、この結果が出た際には、あらためてみなさまにご報告します。
2024年における承認申請に向けて
現在、我々は日本国内で承認申請に向けて、さまざまな活動を行っています。スライドに記載のとおり、具体的には6つの活動を行っています。
まずは、食道がん放射線併用のPhase2です。現在、国内17施設で行っている試験の組入れは完了しており、現在すべての症例のフォローアップを行っています。3回治療を行った後に、もう一度内視鏡で消えたがんが再発していないかどうか、あるいはずっと消えたままでいるのかといったフォローアップを行っています。
2つ目については株主総会でもご質問がありましたが、商用製剤のGMP製造開発を一歩一歩進めています。これはベルギーで行っています。
3つ目に、先駆け審査指定を活かし、今後PMDAとさらに詳細な検討を行い、事前相談などを行っています。PMDAの考え方を十分に我々に取り入れることによって、スムーズな承認申請につなげたいと考えています。
4つ目の製造販売体制については、後ほど詳しくお話ししますが、我々は研究開発のベンチャーとして研究開発体制は持っていましたが、製造販売体制は持っていませんでした。
実際に承認申請を行う上では、やはり製造販売体制もクリアにしなければ承認申請が行えないため、しっかりと体制を構築し、人員の採用も進めていきたいと思っています。
5つ目は、製薬会社との提携交渉です。製造販売体制は確立していますが、「実際に売ることについては、どのようになっているのか」ということについて、もちろん我々が営業担当者を雇い、病院のネットワークの中で「テロメライシン」を売っていくことも可能です。
しかし、できれば消化器に強い製薬企業に、今後の適応追加に共に取り組んでいただけることが理想のため、長期的に関係を持てる会社との交渉を今続けています。できる限り早い段階で、製薬会社、いわゆる販売会社との提携をみなさまにお知らせしたいと考えています。
最後のオーファン申請についても年内の申請を考えています。トップラインデータで十分によい結果が出た場合には、オーファンドラッグとしての申請を行い、優先審査を行っていただき、将来の独占販売権を獲得するという戦略を考えています。
ウイルス製造開発について
現段階でのウイルス製造について、製造担当の樫原取締役よりご説明します。
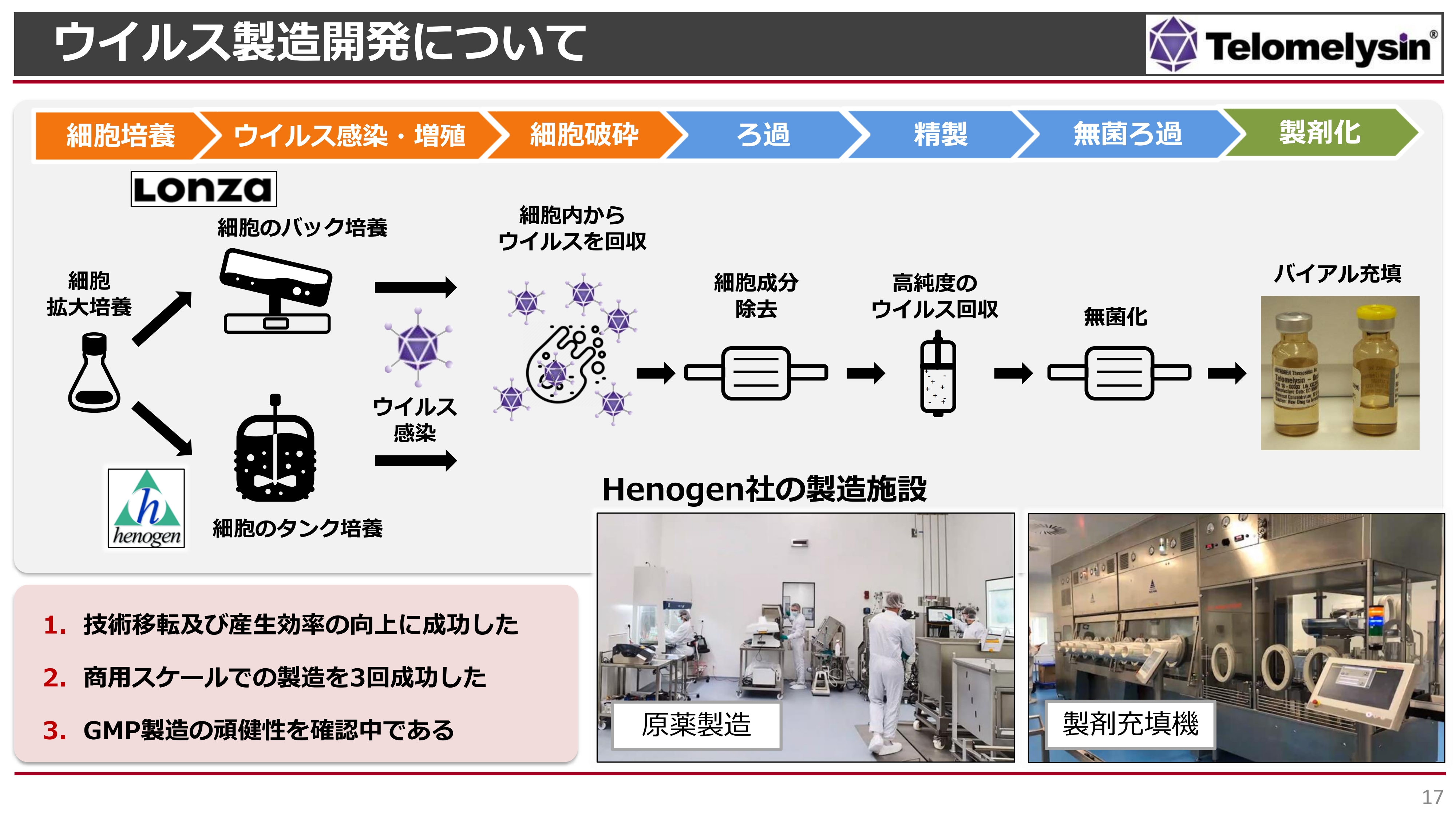
樫原康成氏:これまで我々は、スイスに本社を、アメリカにウイルスの製造拠点を持っているロンザという会社で治験薬を作ってきました。すでに製造に3回成功しており、それらが治験薬としてこれまで使われてきました。
ただし、商用の製造に向けては、より商用製造の経験が高い会社が望ましいと考えていました。また、スライドの図のように、製造時にはバックからタンクへ機器を変えることになりました。タンクでの製造では、「ヘノジェン社のほうが経験が豊富」と考え、選びました。
ご存知の方もいらっしゃるかもしれませんが、2021年1月にこのヘノジェン社はThermo Fisher Scientificという会社に買収されたため、ホームページ上ではヘノジェン社はおそらく見つかりません。現在はThermo Fisher Scientificというグループに属している会社です。
そちらに、ロンザ社で開発してきた製造技術を移管し、すでに製造技術の移転は終了しています。その後、商用スケールでの製造を3回行って成功し、現在GMP製造が進行しているという状況です。
スライド下部には、ヘノジェン社の製造施設の写真を載せています。このような施設で現在、製造開発を進めています。
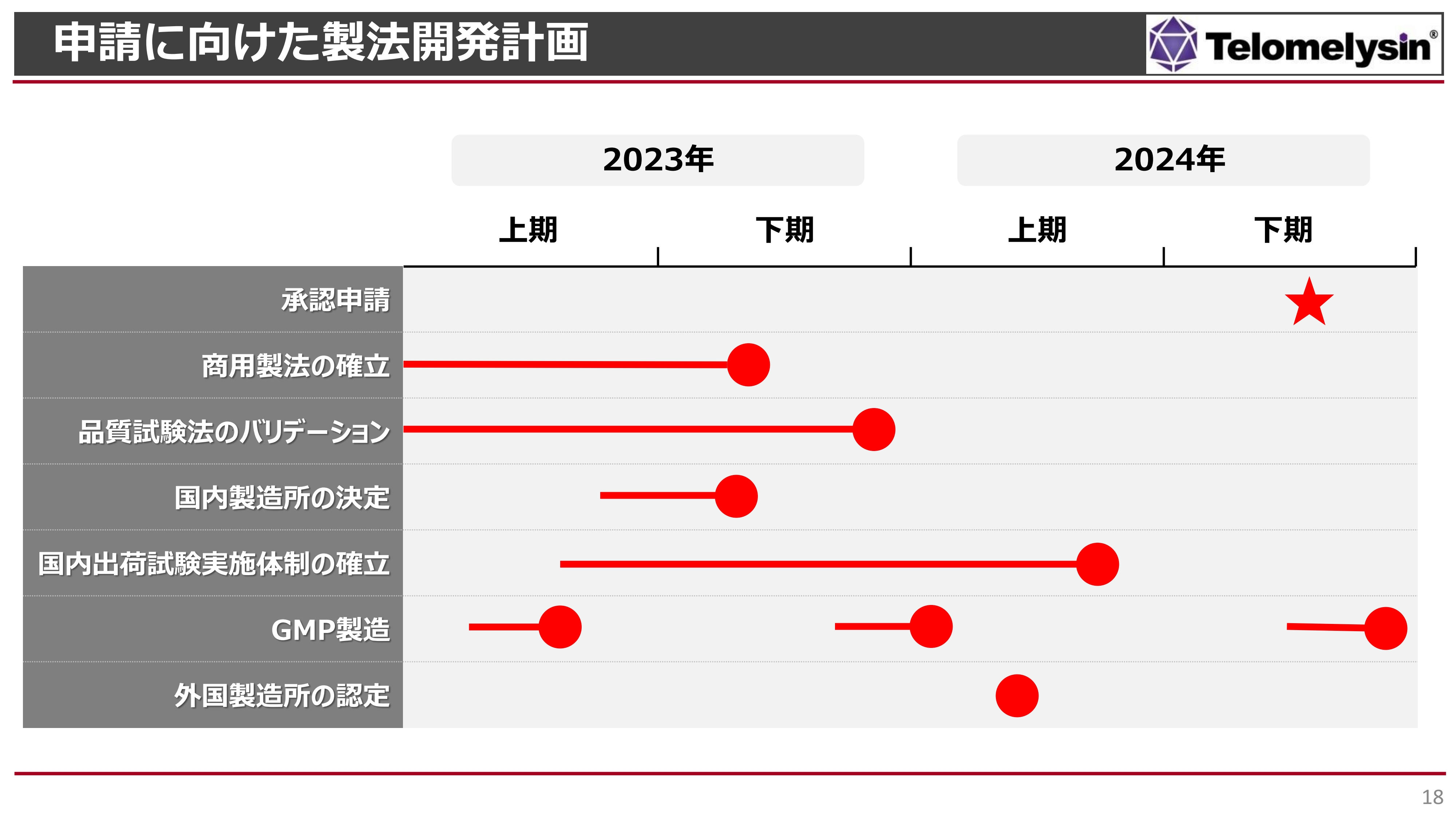
申請に向けた製法開発計画
申請に向けた製法の開発計画です。ご挨拶時にもお話ししましたが、申請前に行わなければならないことが、まだ数多くあります。商用開発では、商用の製法を確立しなければなりませんが、そちらは年内に終えられると考えています。
また、製造できたものの品質を十分に確認していかなければなりません。毎回品質試験の結果が変わってくるようでは困るため、そのようなところのバリデーションも年内に終えるように進めていきます。
ヘノジェン社で作るとお話ししておきながら、スライドには「国内製造所」という少し複雑な言葉を記載しています。後ほどご紹介しますが、現時点では、ベルギーで作った製剤を国内に持ってきて、ラベルを貼ったり箱詰めしたりする予定です。つまり、「テロメライシン」の製造そのものはヘノジェン社で作る一方、最終製品として国内で出荷可能な状態とする必要があるため、「国内製造所」と書いています。
このようなところも年内に決め、出荷試験を国内で実施し、国内での商用製品の流通を行えるように取り組んでいきます。
また、スライドの下から2番目に記載しているGMPの製造は、申請までに3回ほど行い、何回作っても同じ品質のものが作れるかどうかを確認していくことになります。
そして、スライドの一番下の「外国製造所の認定」については、ヘノジェン社は外国にある製造所のため、外国の製造所としての認定を厚生労働省から得ることが必要になります。こちらも申請前に実施する予定で進めています。
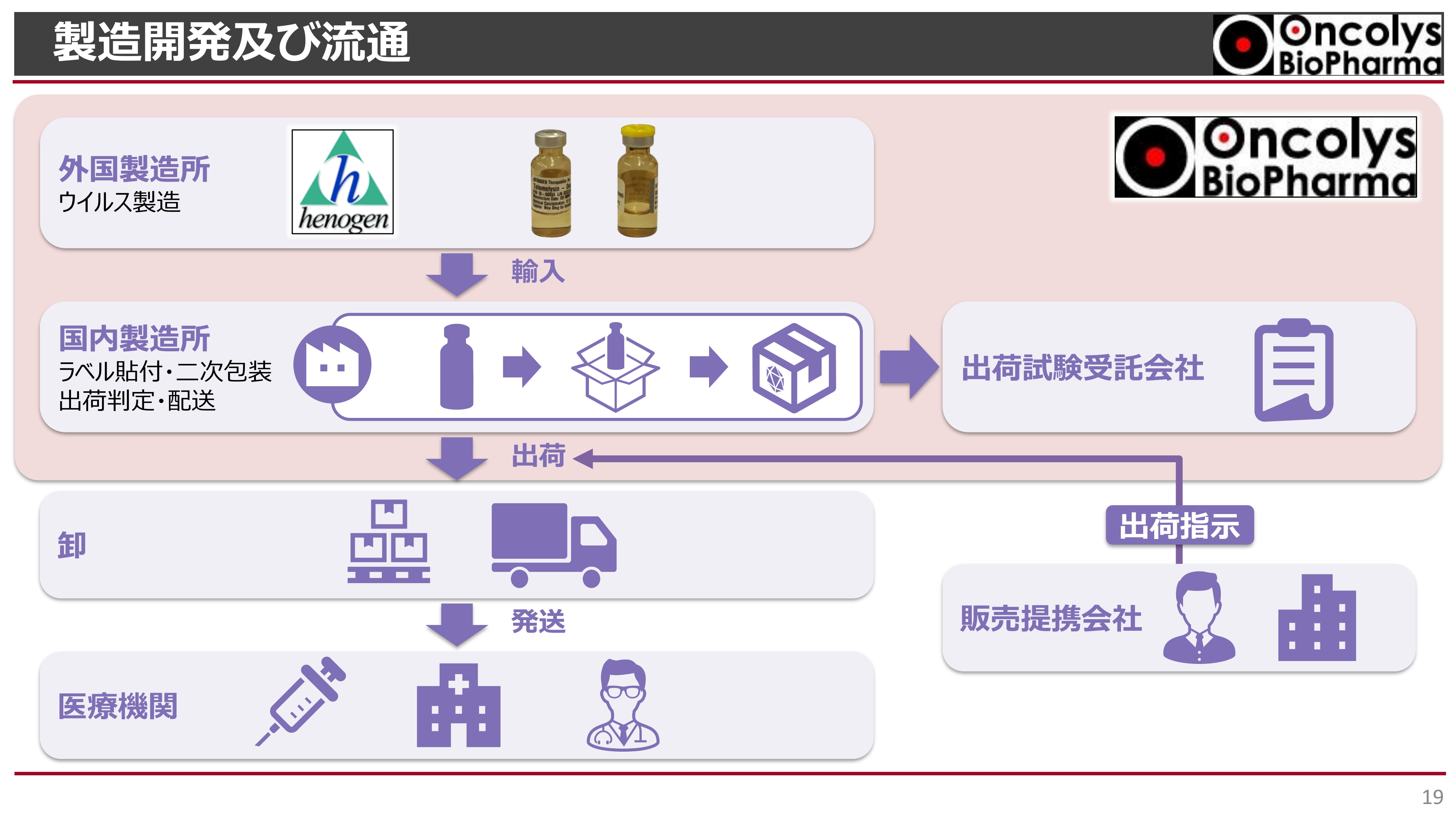
製造開発及び流通
製造開発及び流通の体制についてです。繰り返しになりますが、ヘノジェン社で製造したものを国内に輸入します。その国内製造所で保管やラベル貼り、最終的な二次包装を行った上で出荷していきます。
スライド右上に記載している「出荷試験受託会社」とも国内で提携し、そちらで品質試験を行っていきます。ここまでの部分について、我々が責任を持って品質管理を行っていくことになります。
その後、先ほど浦田よりご説明したように、販売会社と提携し、そちらから出荷の指示、または流通の指示を行っていきます。患者さまへの薬の提供については、このような流れを想定しています。
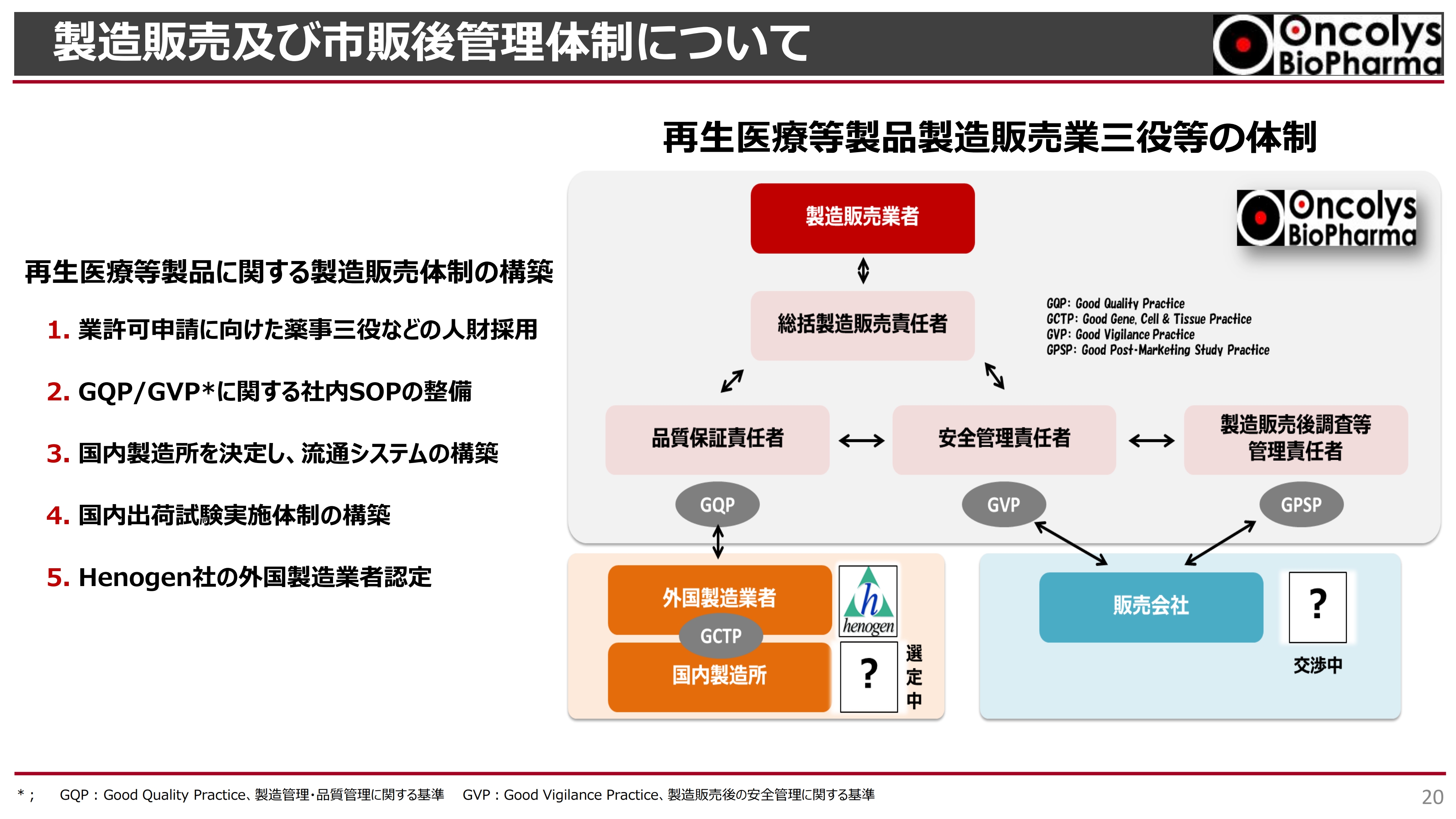
製造販売及び市販後管理体制について
先ほどお話ししたとおり、承認申請を2024年に行うにあたり、この「テロメライシン」は「再生医療等製品」というカテゴリーに属することになります。その再生医療等製品に関する製造販売業務許可を、東京都からいただくことも必要です。
そのためには製薬会社として、三役体制をとる必要があります。スライドの図のように、総括製造販売責任者が総責任者となり、その下に品質保証責任者、安全管理責任者といった重要な役割を持つ3人を置き、品質安全性をしっかりと担保していかなければなりません。
このような体制を、2024年あるいは2025年の頭に構築した上で、2024年に申請ができるように着実に開発を進めていきたいと考えています。製造に関連する説明は以上となります。
浦田:ベルギーのヘノジェン社から日本に持ってきてラベルを貼るという流れについて、マイナス80度くらいで温度を維持管理したまま、飛行機から荷降ろしし、倉庫に入れ、その状況下で日本語のラベルを貼って箱詰めをするという一連の工程はなかなか大変です。
そのため、その工程のプロの会社と組むことが非常に重要だと思っており、すでにいくつかの会社との話し合いを開始しています。
マーケット戦略
マーケット戦略についてです。先のお話になりますが、おそらくこの薬の効能や効果については、「局所進行性の食道がん、ただし、放射線治療を併用すること」になると想定しています。そのような中で、どのようにマーケットを広げていくかを考えています。
毎年、2万人から2万5,000人くらいの方が食道がんに罹患します。そのうち、現状の治療において、「オペは無理だろう」「化学療法も少しきついね」という方は、食道がん患者の10パーセントくらいです。つまり、現状では2,000人を少し超える方が、放射線治療しか受けられない状況になっています。
先ほどからお話ししているように、放射線治療だけの場合、30パーセント以下の患者さましかがんが消えない状況になります。
許可が取れた場合には、例えば高齢や心臓が弱いために長時間の手術ができない方が対象になる見込みです。また、肝機能障害、あるいは腎機能が悪いために、化学療法が無理だという方も想定しています。
さらにもう1つの例として、スライドの上から3つ目に記載しているように、誰しもが思うことですが「手術が嫌だ」「食道を残したい」という患者さまについても、今後「テロメライシン」の対象になってくるのではないかと思います。
それ以外にも、例えば「ペムブロリズマブ」などで治療されて、全身はよくなったものの、局所の食道の閉塞が残ってしまって食事ができないという方に対し、嚥下障害を改善するということで「テロメライシン」の注射がよいだろうと判断される可能性もあるのではないかと考えています。
このような例を考えていくと、現在のマーケットでは2万人から2万5,000人のうち、10パーセントくらいが当てはまるとお話ししました。しかし今後、例えば「食道を残したい」あるいは「もう手術が嫌だ」という方々が増え、医師からも「『テロメライシン』なら効くのではないか」という信頼を得ることによって、マーケットがより拡大していくのではないかと我々は考えています。
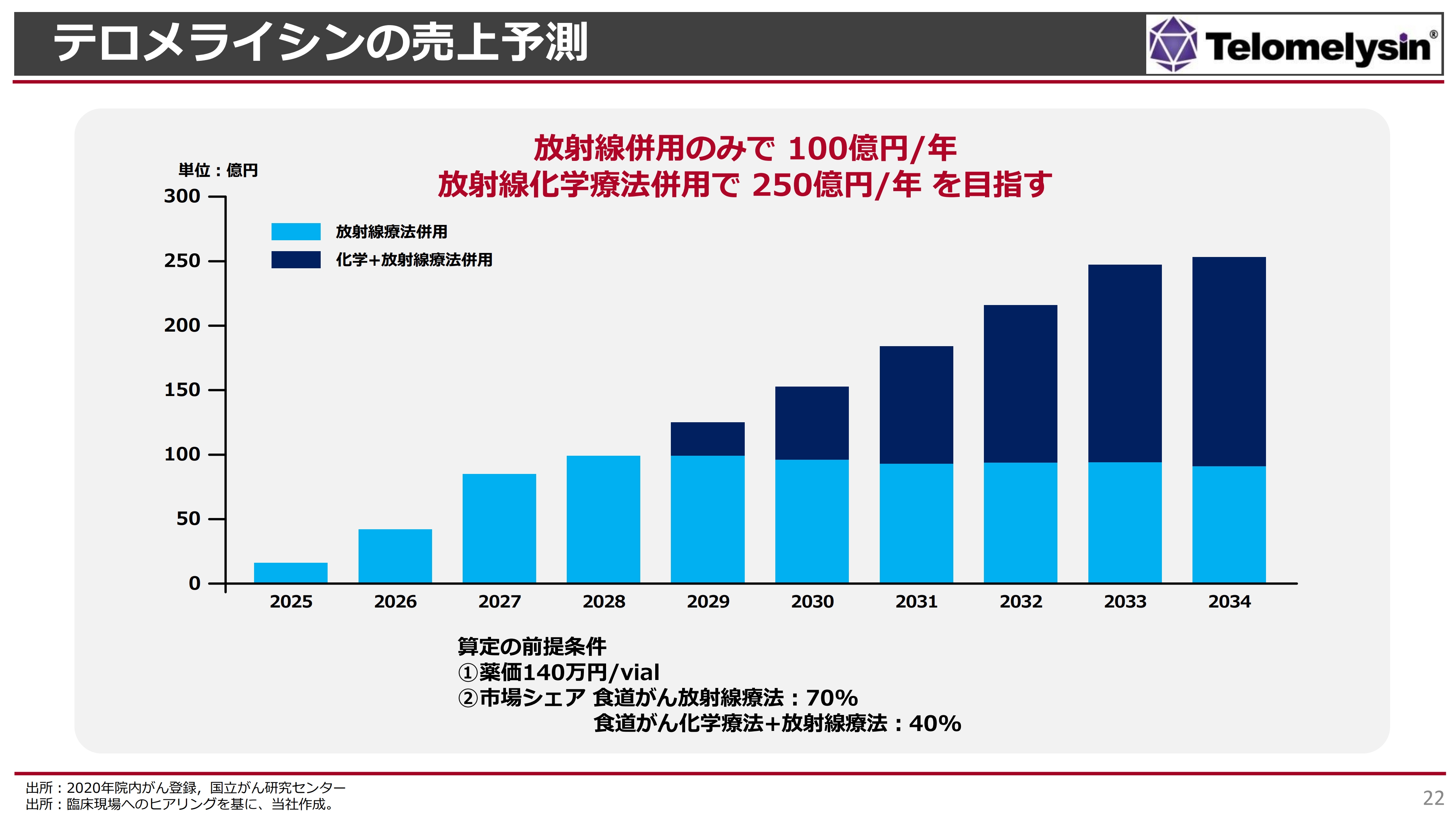
テロメライシンの売上予測
「テロメライシン」の売上についての単純なシミュレーションです。なお、2025年から発売される前提です。
この薬価がなかなか曲者で、みなさまもご存知のように、すでに第一三共株式会社がヘルペスウイルスを脳腫瘍で承認取得しています。全部で6回治療するという治療方法ですが、この「デリタクト」という薬剤には、1バイアルあたり140万円の薬価がついています。これが1つの基準になると思います。
「テロメライシン」も非常にコストがかかる製造を行っているため、我々はさらに高い薬価を狙っていきます。仮に1バイアルあたり140万円という薬価が付いた場合、最初の数年間で少しずつ「テロメライシン」の評判が広まっていき、だいたい4年から5年の間に約100億円を超えるだろうと試算しています。
これは、放射線との併用療法でしか使えないという患者さまは2,000人くらいを標準に考えていますが、この8割くらいの患者さまで使えるようになったという前提です。
次に、棒グラフの2029年以降をご覧ください。上のほうに少し濃い色で示した部分についてご説明します。化学療法と放射線を組み合わせた、放射線化学療法というものがあり、我々の業界ではこれを「ケモラジ」と呼んでいます。
この併用療法の上乗せによって「テロメライシン」の効果が上がるという試験結果はまだ出ていませんが、仮に効能を追加できた場合、オーファン指定をすると、今後だいたい10年間は独占販売ができ、200億円から250億円くらいの売上になるのではないかと考えています。
現段階で、この食道がんの局所を狙った新薬というのは、日本だけでなくアメリカでもまだ1つも発表されていません。我々が世界で初めてとなるため、当面の間は単独でこの食道がんのマーケットを占有できるのではないかと考えています。
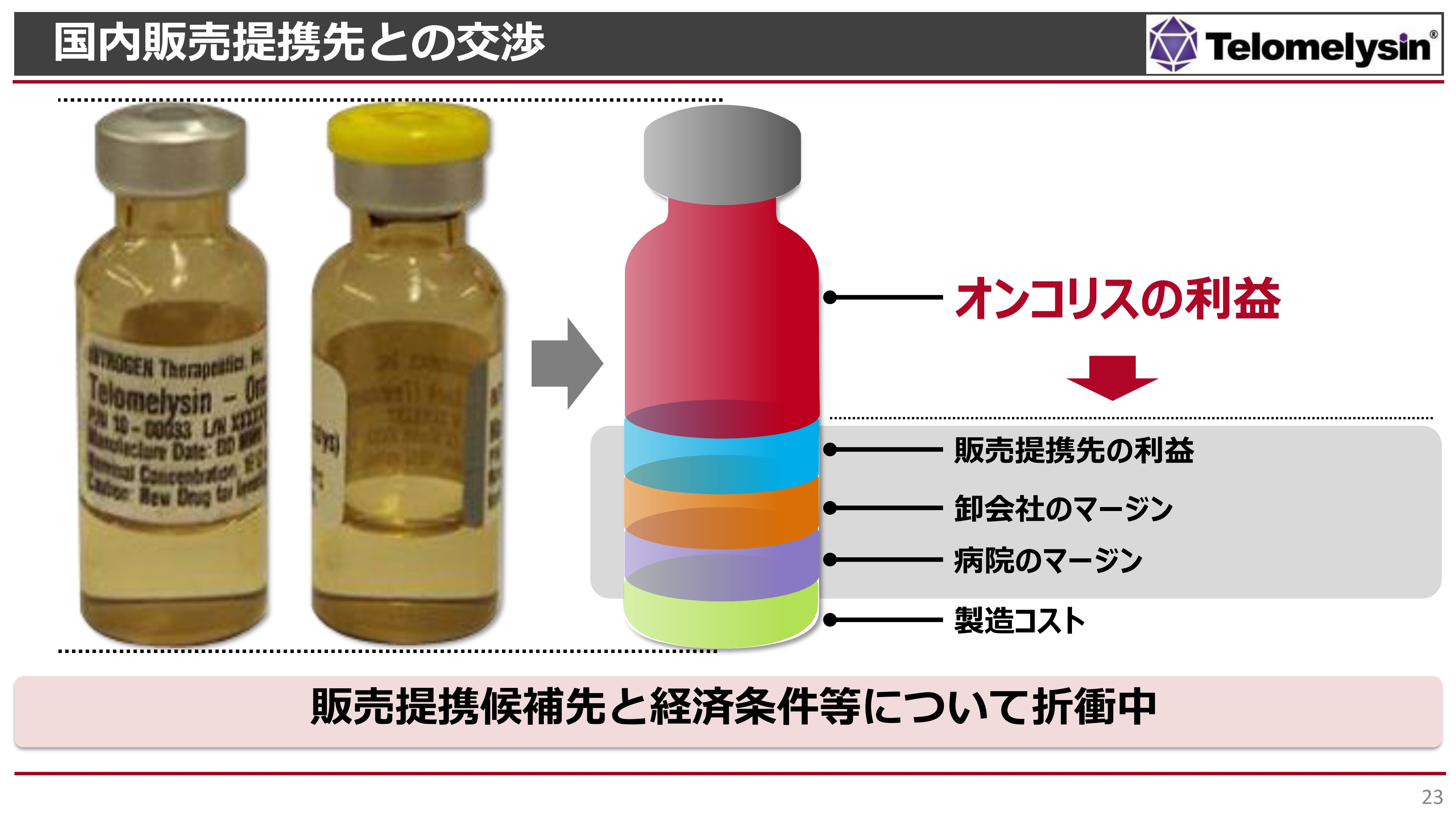
国内販売提携先との交渉
国内販売先との提携についてです。こちらもできる限り早くみなさまにご報告したいと考えているものの、最終段階でのマーケットサイズの問題もあり、利益の配分に関する交渉が続いています。
先ほど1バイアルあたり140万円の薬価を例にお話ししましたが、我々はより高い薬価を狙っていきたいと思っています。スライドで示しているとおり、一番下の緑色の製造コストは、現段階でヘノジェン社においては下げることはなかなか難しいという状況です。
その上にある3つは、いわゆる販売会社の利益や経費、卸会社のマージン、そして病院のマージンになります。病院もやはり薬価差での収入を狙っているため、このようなマージンを差し引かれた一番上の赤い部分だけが当社の純粋な利益になります。
この利益の部分を、どのくらい我々が死守していくかが非常に大きな課題であり、これが今後の販売提携先との交渉で大きな争点になっていくと考えています。
ただ、あまり長引かせることも得策ではないと思っているため、よいところで落ち着ければと考えています。以上が「テロメライシン」の状況です。
censavudine(OBP-601)とは
「OBP-601」についてです。こちらはもともと抗HIV薬として開発してきた化合物ですが、現在は神経難病への可能性を追求しています。
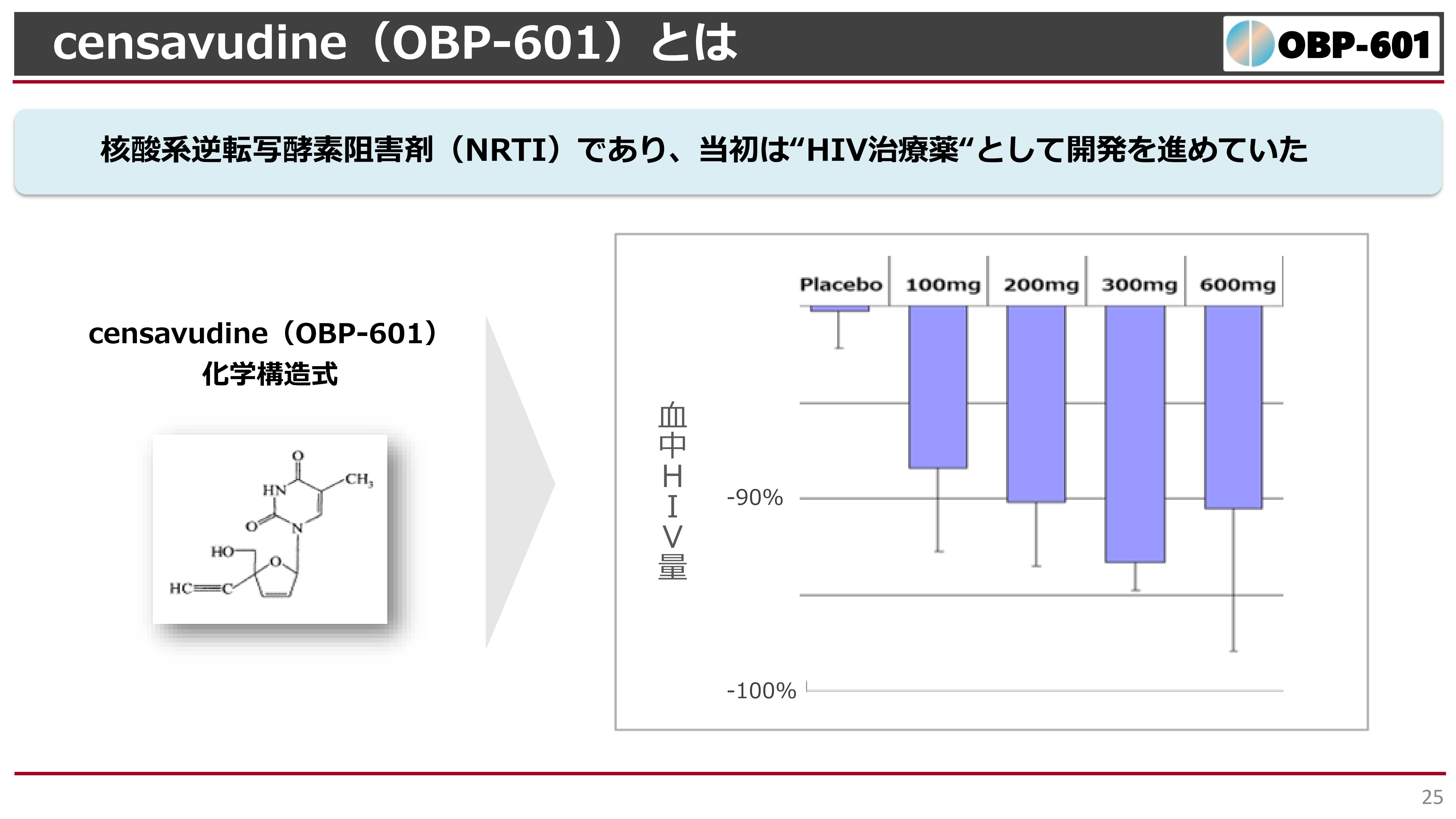
「censavudine」という一般名がつきましたが、これは核酸系逆転写酵素阻害剤(NRTI)で、エイズの治療薬としても非常に基本的な薬です。スライドに記載のとおり、構造式は低分子の化合物です。
スライド右側のグラフは、我々がフランスで行ったPhase1の結果です。HIVに感染した患者さまを集め、プラセボ(偽薬)、100ミリ、200ミリ、300ミリ、600ミリを1日1回経口投与し、10日間エイズ患者さまの血液中のHIVを観察しました。
その結果、この治験では300ミリの投与群で血液中のHIVが、たった10日間で95パーセント近く低下しました。この非常によい結果をもとに、アメリカのBristol Myers Squibb(BMS)という製薬会社へのライセンスアウトが、2010年12月に行われました。
しかし、このBMSが全世界でPhase2臨床試験を行い、既存の抗HIV薬と遜色のない非劣性であるという結果を出したにもかかわらず、2014年の段階で当社はこの契約を打ち切られてしまいました。
その理由は明らかにはしていただけませんでしたが、このBMSは抗HIV薬のフランチャイズを売却してしまい、それ以降エイズの事業は行わなくなったようです。
加えて、BMSは2014年頃に「オプジーボ」の開発に全資源を投下するという判断を行い、その段階で残念ながら我々は抗HIV薬としての開発は断念せざるを得ないということになってしまいました。
神経変性疾患治療薬としての開発着眼点
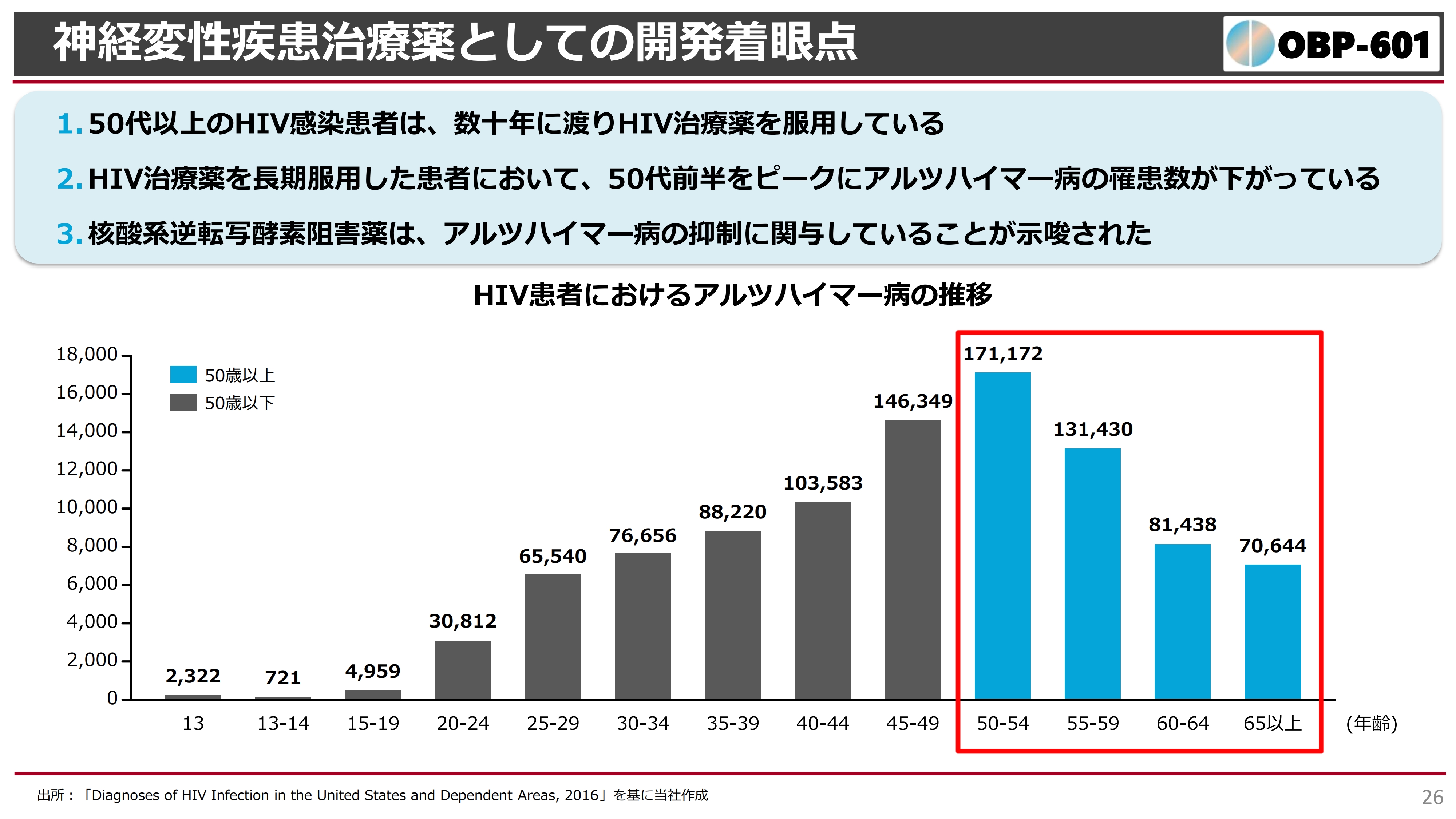
その後、さまざまな会社と話し合いを行っていましたが、アメリカのブラウン大学が、いろいろな疫学調査を調べた結果、非常に興味深い結果が出てきました。
スライドには、HIVに罹った患者さまのアルツハイマー病の発症率を示しています。現在、50代以上、むしろ高齢者になるほどアルツハイマー病を発症しないという結果が得られています。これは非常に興味深い結果です。
なぜこのような結果になったのかについて、次のように推察しています。HIVに感染した方は、抗HIV薬を一生飲んでいかなければなりません。この薬は、血液中から徹底的にHIVをなくし、ふだんの生活を行えるようにするという着眼点での薬です。
60代の方、あるいはそれ以上の方は、おそらく20年以上抗HIV薬を服用していますが、そのような方のアルツハイマーの発症が少ないため、抗HIV薬になにか作用があるのではないかという研究が行われてきました。
censavudine(OBP-601)の新規メカニズム
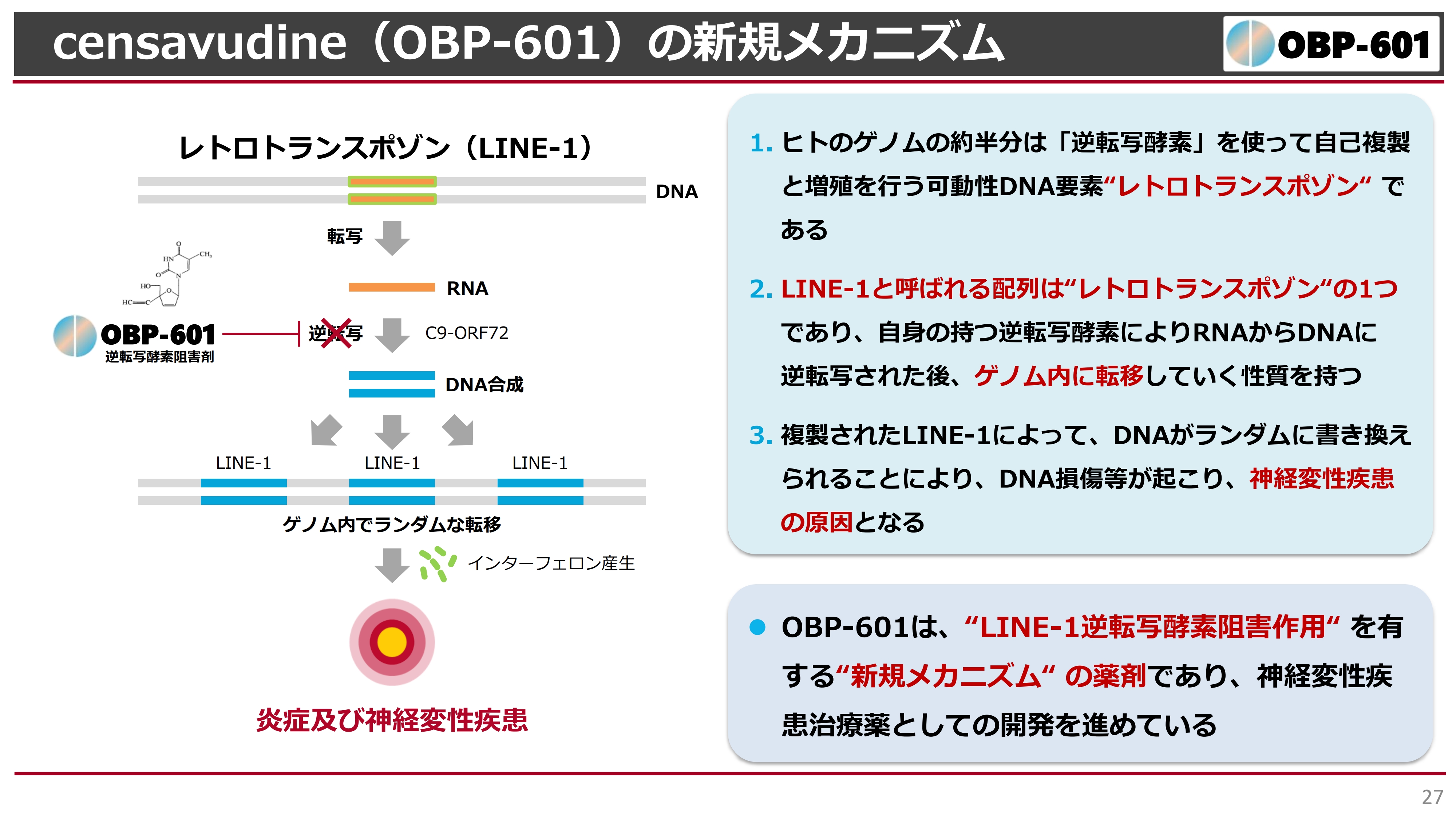
その研究結果を、こちらのスライドに示しています。少し難しいため、詳細な説明は省きますが、スライド左上にある「レトロトランスポゾン(LINE-1)」という遺伝子が、我々の二重螺旋の中にあります。
我々の遺伝子の40パーセントくらいは、謎の遺伝子と言われていますが、その中にこのレトロトランスポゾンというものもあります。
地上の生物は、太古の時代に水の中で魚のように生活していましたが、だんだんと地上に出てきて哺乳類になってきました。その頃にはすでにウイルスがあり、我々のゲノムはHIVのようなウイルスに罹り、ゲノムもどんどんと伸びてきたという歴史があります。
このレトロトランスポゾンは、おそらく太古の昔に人間がウイルスに感染した遺伝子です。これが、ある遺伝子疾患においては、特にこの逆転写酵素阻害剤の異常によって、我々のゲノムのあちこちにどんどんと転移してしまう現象があります。
このレトロトランスポゾンは、浮遊する遺伝子とも言われており、いつどこに入ってくるかがわかりません。特にこのLINE-1は、我々の二重螺旋のあちこちに転移してしまうと、スライドの図にあるように、炎症性の変化が発生します。また、インターフェロンが産生され、脳の神経に損傷をきたします。
このような1つの科学的な仮説を、アメリカのブラウン大学が証明しつつある状況です。
censavudine(OBP-601)の特徴
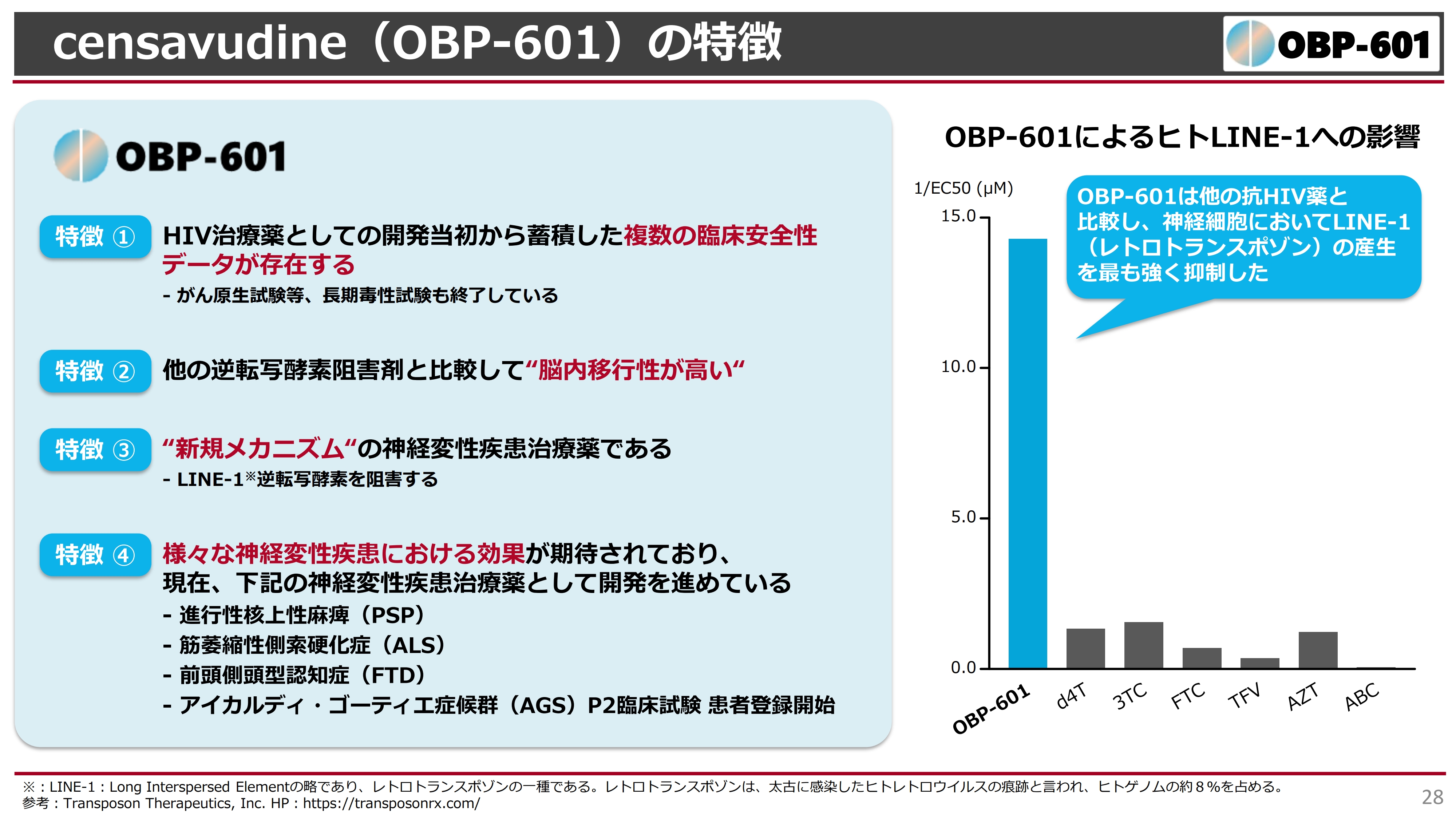
「OBP-601」がなぜ受け入れられたのかというと、臨床試験がPhase2まで終了し、ネズミでの長期毒性試験もすべて終了していたところが、非常に安全性が高いということで、アメリカのブラウン大学、またはブラウン大学発のTransposon社に着目されたことが挙げられます。
また、非常に溶けやすい化合物で、他の薬に比べて脳内移行性が高いことが示されています。したがって、中枢性の神経変性疾患に非常に効くのではないかと考えられました。
スライド右側のグラフは、「OBP-601」によるヒトLINE-1への影響の結果を示したものです。「d4T」「3TC」「FTC」などは、すでにジェネリックが作られている抗HIV薬で、世界中で使われています。これらと比較して、「OBP-601」がヒトLINE-1の産生量をどのくらい下げられるかについて研究し、既存の抗HIV薬よりも「OBP-601」のほうがはるかに活性が高いという結果がブラウン大学で得られました。
この結果から「OBP-601」は、いろいろな神経変性疾患に効くのではないかと考えられており、最終的にはアルツハイマー病でも試していきたいと思っています。しかし、現在アルツハイマー病については抗体薬などの競争が激しいところがある上、薬の効能を何年にもわたって評価しなければならず、効果がわかりにくいというのが現状です。
聞きなじみがない病名だと思いますが、進行性核上性麻痺(PSP)やALSというホーキング博士が罹ったような全身の筋肉が萎縮するような病気、そして元俳優のブルース・ウィリス氏が罹ったというニュースがあった前頭側頭型認知症(FTD)といった難しい病気があります。
このような病気で評価していけば、もう少しいろいろなバイオマーカーや日常生活動作がより短期間で評価できるのではないかと考え、アルツハイマー病の前にこれらの疾患で臨床試験をしようという計画が我々に提出されました。
ライセンスと開発状況
2020年6月に「OBP-601」を開発するために設立されたTransposon Therapeutics社とライセンス契約を結んでいます。対象疾患は神経性疾患全般で、契約総額は販売ロイヤリティを除いても3億ドル以上、日本円で400億円近い金額となっています。コストはすべてTransposon社が負担するということで、我々は結果を待つという状況です。
Phase2a臨床試験が欧米にて進行中で、現在3本目の臨床試験が行われています。スライド青枠内の1つ目の進行性核上性麻痺(PSP)はパーキンソン病とよく似ています。手足が震えてしまうといった症状が出たり、これはパーキンソン病とは少し違いますが、すぐ歩けなくて倒れてしまうような症状が出たりします。
試験デザインは二重盲検試験であり、我々もまだ結果はわかりませんが、すでに組入れが終わっており、2023年中にはトップラインデータが出てくる予定です。
2つ目は筋萎縮性側索硬化症(ALS)・前頭側頭型認知症(FTD)の中でも特にC9についてです。ある逆転写酵素異常によって起こったALSやFTDに対しても組入れが終わったという報告を受けています。
3つ目はアイカルディ・ゴーティエ症候群(AGS)という、子どもの頃に発症していろいろな認知機能の麻痺や、頭が小さくなってしまう小頭症のような症状が出てきて長く生きられないという病気があります。このような疾患に対しても、現在ヨーロッパで臨床試験が進められています。
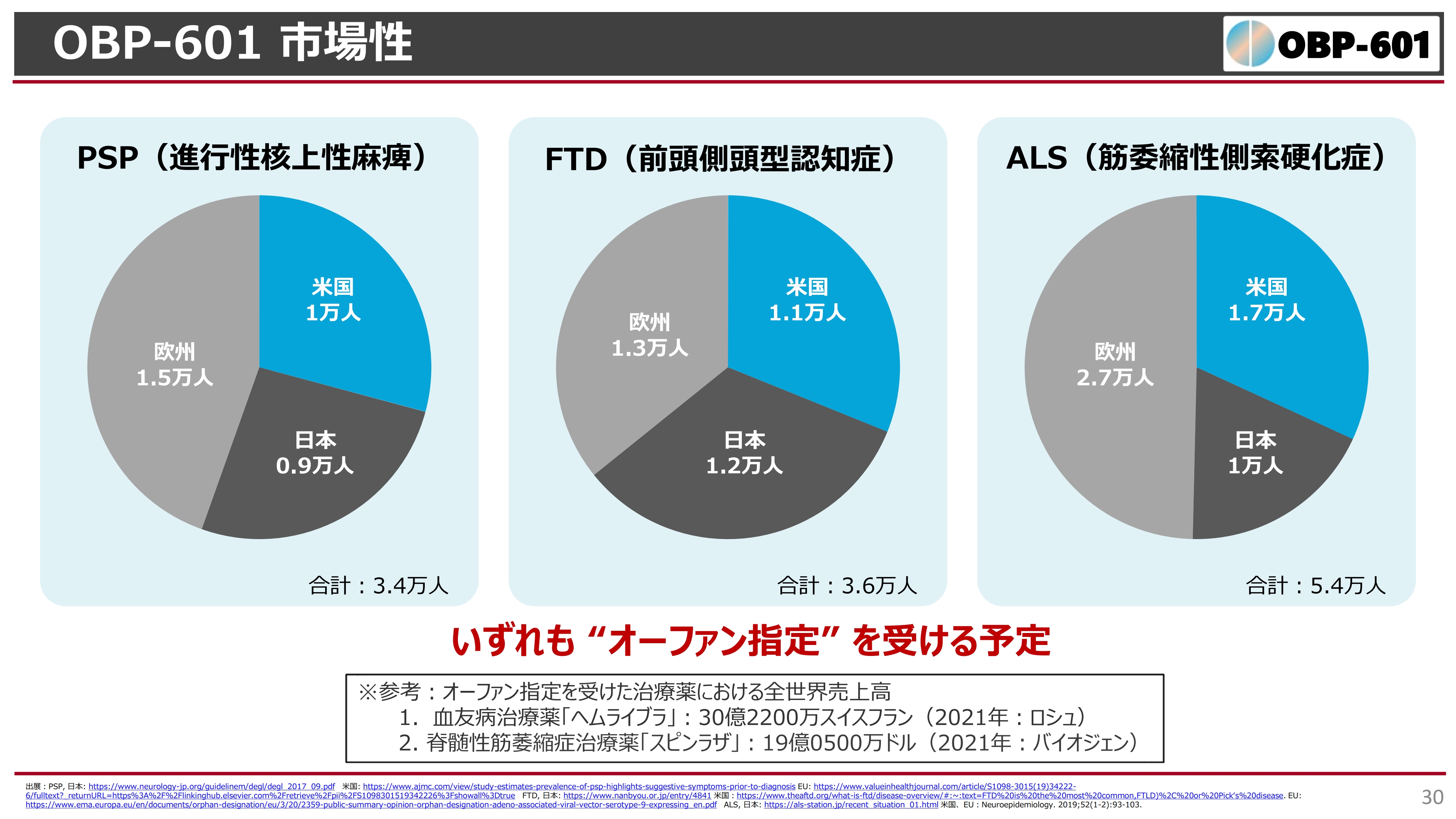
OBP-601 市場性
「OBP-601」の市場性です。PSPの患者は世界で3万人程度、日本は1万人程度で、FTDやALSは世界でも3万人から5万人程度と非常に少なく、いずれもオーファン指定を受けるような疾患です。したがって、確実に効くものであればおそらくオーファン指定を受けて、高薬価を取れることになると思います。
このPhase2の試験で明らかなバイオマーカーあるいは症状の変化を見受けることができれば、おそらく大手とライセンス契約を結べるだろうと私は期待しています。以上が「OBP-601」の現状についてです。
その他のパイプライン
最後にその他のパイプラインについてご説明します。
OBP-2011 抗ウイルス薬
新型コロナウイルス治療薬として開発した「OBP-2011」は、前臨床試験の8割から9割ほどが終了し、GMPの製造も終わりました。
スライド右側のグラフは、従来株やアルファ・ベータ・ガンマ・デルタ・オミクロンなどの株に対しても非常に強い効果があることを示しています。また、SARSやMERS、一部のインフルエンザウイルスにも効果があることが示されています。
しかし、昨年もお伝えしていたとおり、パンデミックが徐々に収まりつつあるため、臨床試験もなかなか行いづらくなっている状況であり、ゾコーバも許可を取るのに苦労しました。「ゾコーバ」に関しては、昨今の臨床試験データによると、ウイルスを下げることには成功したものの、入院率や死亡率にはあまり影響しなかったとのことです。昨年「OBP-2011」のパイプラインのプライオリティを下げました。
現段階では多額の資金を使うということではなく、国立感染症研究所あるいは鹿児島大学で詳細なメカニズムの解明を行い、例えば新型コロナウイルスではなくエボラ出血熱やデング熱など、まだ治療薬のない領域での開発ができるのかどうかを検討しています。
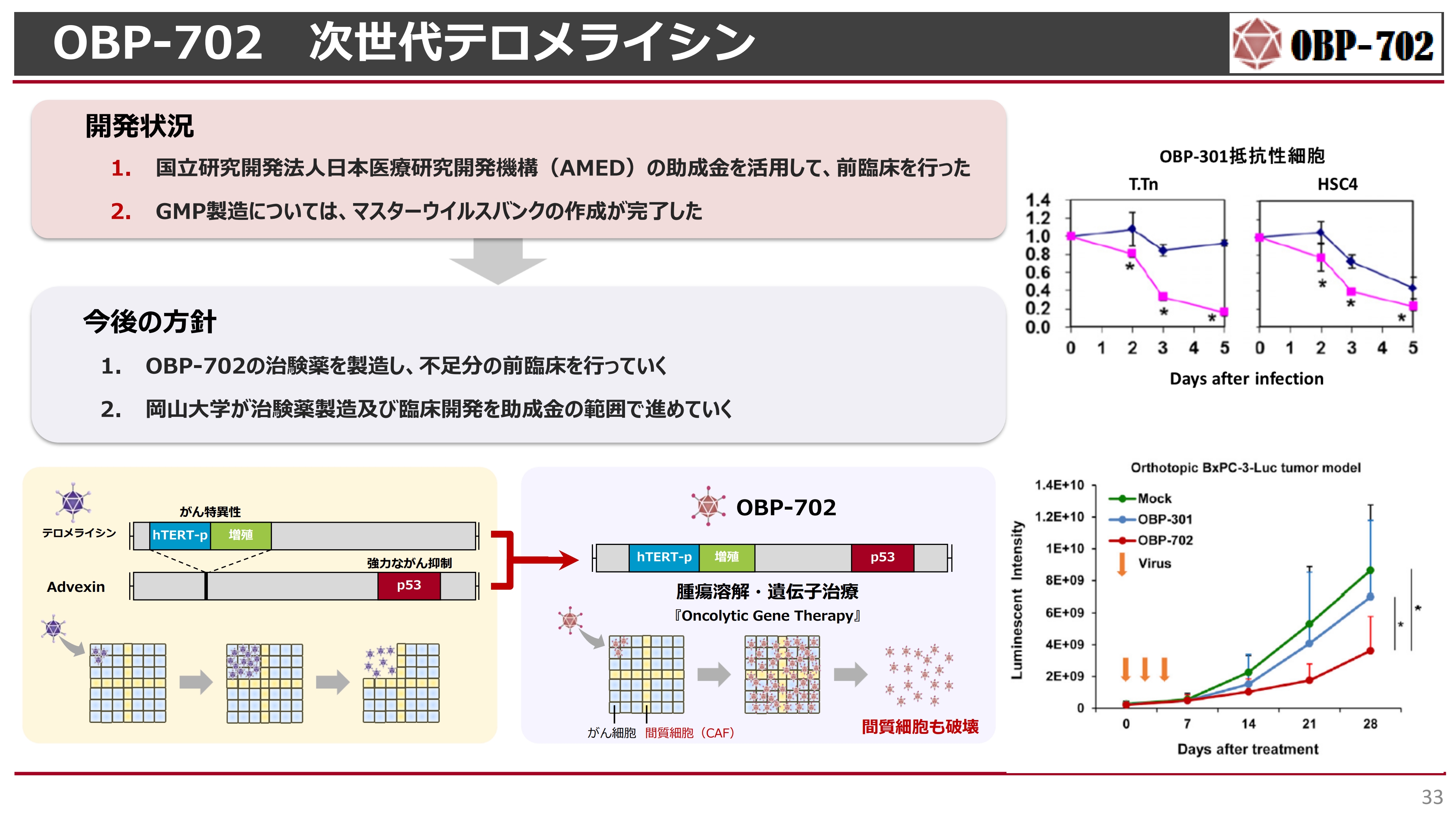
OBP-702 次世代テロメライシン
第2世代の「テロメライシン」についてです。こちらは「テロメライシン」の構造の中に我々の細胞が持っている最も強力ながん抑制遺伝子である、「p53」というファクタを組入れた新しい腫瘍溶解ウイルスです。現在、岡山大学でいろいろな非臨床試験を行っています。
岡山大学は今年度まで、AMEDの補助金を活用しており、その範囲内で当社が資金を受け取りながらGMPの製造を行ってきました。現状、GMPの初期段階は一応終了しています。
今後も膵臓がんや胃がんの腹膜転移などで岡山大学と臨床開発していく予定ですが、我々は現在「テロメライシン」に開発資源を集中しているため、科学研究費等の助成金の範囲内で開発していきたいと考えています。
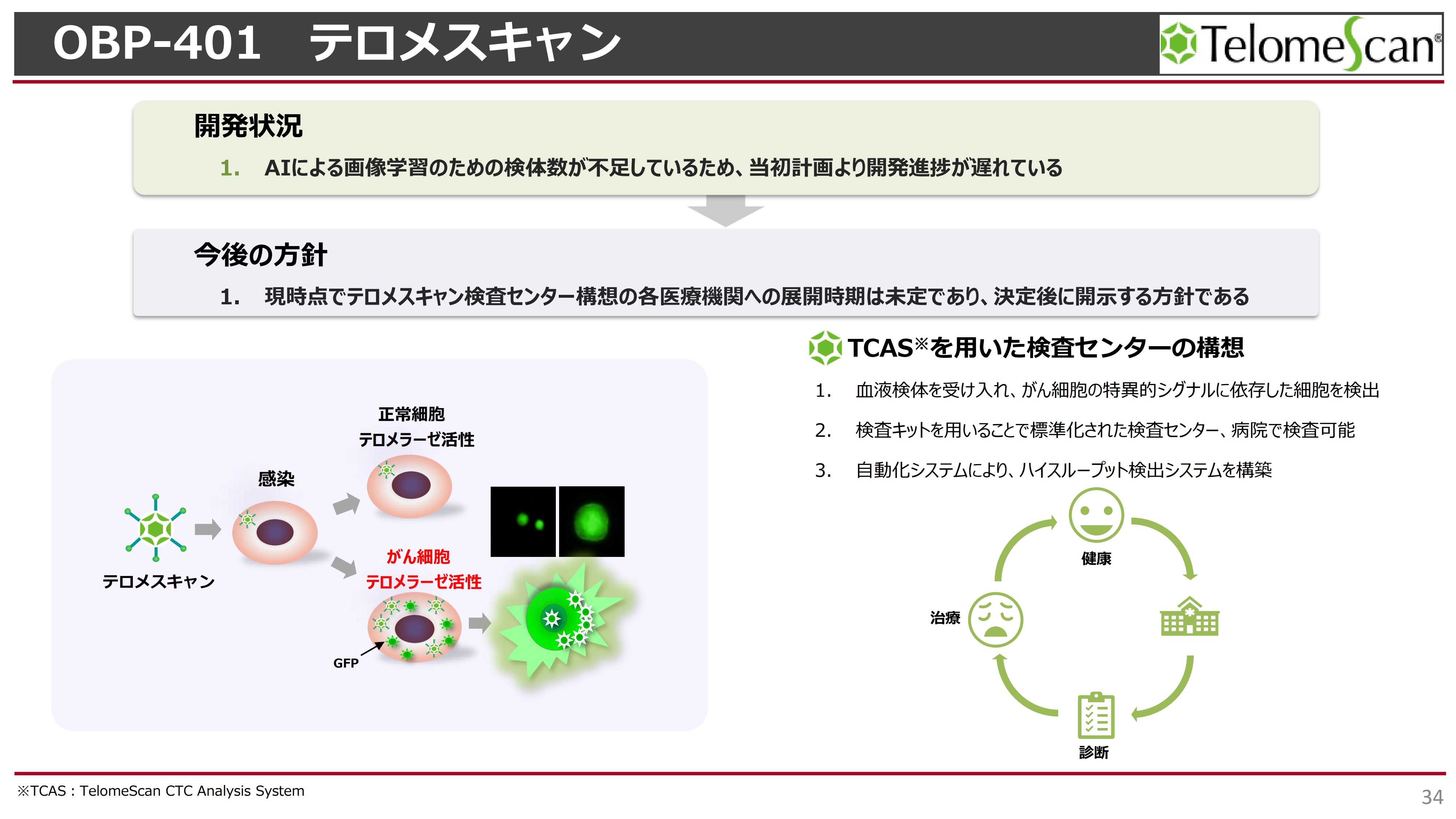
OBP-401 テロメスキャン
「テロメスキャン」についてです。こちらも血液中の循環がん細胞を検出する目的で開発が始まりました。以前我々は、AIを使ったシステムを構築し、自動的に血液中のTCASと呼ばれる循環がん細胞を確立し、検査センターを作りたいというお話をしました。
現在、順天堂大学から臨床検体を取り寄せてAIに学習させていますが、検体数が不足しており、若干開発が遅れています。
パイプライン開発一覧
パイプライン開発の一覧です。我々は「テロメライシン」を上市することが非常に大きな目的になっており、その時期が徐々に近づいてきています。
「今後の目標」の進捗状況(1/2)
「テロメライシン」についてはスライドのグラフでも示しているとおり、症例の組入れが終了し、先駆け審査指定の中外製薬からの承継も終了しました。それ以降はGMP製造、販売体制の確立、パートナーの獲得や海外の共同開発に向けて、年内にこのような目標を完了したいと考えています。
「今後の目標」の進捗状況(2/2)
その他パイプラインの今後の目標はご覧のとおりです。
2023年にオンコリスにご期待頂きたいこと
2023年に当社にご期待いただきたいこととして、1つ目に「テロメライシン」の国内販売パートナーとの提携を行いたいと思っています。
2つ目は、年内にPhase2のトップラインデータをみなさまにきちんとご報告したいと思っています。
3つ目は「テロメライシン」の商用製造法をしっかりと確立させ、安定した国内供給が行えるようにしていきたいと思っています。
4つ目は、アメリカでの胃がんの臨床試験において、海外の製薬会社との共同開発契約を取り付けたいと考えています。
5つ目は、製造販売体制を確立していきたいと思っています。すべての項目を実現できるかわかりませんが、全力で5つ目までは達成したいと思っています。
6つ目の「OBP-601」のトップラインデータについては報告された後、みなさまにもできるだけ早く報告したいと考えています。
質疑応答:Transposon社に関して
質問者:Transposon社に関してのご質問です。Transposon社は期待をはるかに上回る治験のスピードに驚嘆しています。私は長い間、日本のバイオベンチャーを見ていますが、治験は遅れる印象があり、遅れる企業は治験が上手くいっていないイメージを持っています。しかしTransposon社は、すべてを前倒ししているように見受けられます。大手企業はいろいろな分野の治験を扱っているため、方向性の転換でやめてしまうこともありますが、Transposon社は「OBP-601」について背水の陣で臨んでいるスピードではないかと非常に期待しています。
仮にトップラインデータをPhase2aとして、結果が非常によかったとすると、Phase2b、Phase3まで進んでから承認申請をすると思うのですが、Transposon社のこれまで進行速度のすばらしさと、浦田社長のご経験を踏まえて、Phase3の終了はいつ頃になると考えていますか?
浦田:私は、Transposon社の社長とも何度もお会いしていますし、Transposon社の開発メンバーとの会議にも参加しています。大変システマティックに開発を進める会社で、非常に組みやすい会社だと感じています。
「OBP-601」のトップラインデータについては、さまざまなプロトコルがありますが、例えば神経疾患では「手が震えて字が書けない」「歩いているとすぐに倒れてしまう」、認知機能では「100から3を引いたらいくつですか?」「97から3を引いたらいくつですか?」などといったいくつかの問診を行っています。そのような問診に加え、日常生活動作に関することなど、非常に多くのマーカーを取っています。
Transposon社の治験がすばらしいのは、それ以外にも脊髄液からレトロトランスポゾンの転移に関わる10種類以上のバイオマーカーを取っていることです。
これらの結果について「有意差をもってすべてよい」という結果にはならないとは思いますが、このような神経疾患は一生のものですので、実際の臨床試験では、Phase3において1年、2年といった期間投与しなければ、本当の意味での患者の転帰はわからないと思います。
そのようなことを考えると、いくつかのマーカーが動き、トップラインでよい結果が出て、QOLの評価が確認された後に、FDAと「End of Phase2 Meetings」を行うことになります。そして、このような重い疾患には治療薬がありませんので、二重盲検試験で客観的に評価されていることが認められた場合、うまくいくと最終試験の「Phase2/3」に進みます。
そうなった場合、難治性の疾患ですので、患者の予後を見るには1年くらいの投与が必要で、そこから判断するというPhase3になると考えています。
なおかつ、二重盲検試験の結果にもよりますが、例えば1群で50例から100例、プラセボは50例、2対1の組入れで行うとなると、日本も入るかもわかりませんが、全世界で150例です。彼らのやり方では、おそらく2年半くらいで結果が出てくるのではないかと思います。
今年トップラインデータが出てきて、年内にFDAと次の話をすれば、来年から「Phase2/3」に入ることになります。キーオープンまで2年半から3年かかるとすると、2027年頃には大きな結果が出てくると考えています。
ただし、Phase2aでかなりよい結果が出たら、その段階で製薬メーカーがおそらく黙っていないのではないかとは感じています。
質疑応答:「テロメライシン」の販売提携遅延ついて
質問者:昨年の事業説明会で、「『テロメライシン』と『OBP-2011』では、前者のほうが提携の可能性が高い」と発言されたのを記憶しています。しかも、「一応、年内を見込んでいる」と発信されましたが、実際には何もなかったという状況です。
交渉先がある話ですので、思いどおりにならないことも当然あるとは思いますが、発信のように進まなかった理由を教えてください。見通しが甘かったのか、それとも、それ以外にも何か要因があったのでしょうか?
浦田:「テロメライシン」の提携を昨年内になんとかしたいとお話ししましたが、そのご報告ができなかったことは大変申し訳なく思っています。
これまで10社以上と販売提携について話し合ってきました。食道がんに対するウイルス製剤ということで、最初の段階では「おもしろい。進めていきましょう」と、いくつもの会社が賛同してくれました。
しかし、デューデリジェンスを重ねると、「自社の力では、この新しいウイルス製剤を取り扱うのは無理だ」「マーケットサイズは100億円から200億円とのことだが、もっと大きくなくてはダメだ」などいろいろな条件があり、行ったり来たりで話し合いに時間がかかってしまいました。
加えて、先ほどお話ししたとおり価格交渉で難航していたため、有言実行できずに申し訳なく思っています。今後はとにかく努力していきたいと思います。
質疑応答:コラムについて
質問者:年初からいつも楽しみにしているコラムについてです。「新年早々からダッシュしていきたいと思います」とのコメントがありました。「スタートダッシュ」という表現から、一般論から考えて遅くとも第1四半期の3月末くらいまでに何かあるのではと思っていました。
研究や交渉など、公表できない内容で相当なスタートダッシュができているのかもしれませんが、公表できない内容なのであれば、なぜ「スタートダッシュ」という言葉を使ったのか気になっています。
浦田:我々は研究開発の会社ですので、ダッシュしてすぐに結果が出るものではありません。承認申請をしたり、臨床試験についても最後の組入れが終わったらデータにまとめたり、あるいはPMDAとも交渉したりしなければならないのですが、物事が発生してから動いたのでは遅いと考えています。
そのため、「今のうちに動けるだけ動いて、そのかわり、途中でいろいろな問題が起こった時に、きちんと考えられるように準備しよう」という意味を込めて、社員に「ダッシュ」と号令をかけたとご理解いただければと思います。
質疑応答:共同開発の提携内容について
質問者:共同開発の提携内容について、資金面を含め従来との違いを教えてください。また、販売先との提携とは、あくまで販売手数料を支払うのみでしょうか?
浦田:アメリカにおける共同開発は、「胃がんに効くかどうか一緒に組んで進めましょう」というものです。相手側の資金や物品の調達などは、今後の話し合い次第だと考えています。
販売提携については、我々がしっかりとGMP製造を行い、漏れなく遅滞なく製品を市場に届けることができるように、資金投下していただける会社が理想です。なおかつ中長期的な製品価値向上にお付き合いいただける会社を最優先として考えています。
結果的に販売のみになる可能性もありますが、できる限りそのようなお付き合いとならないことを希望します。
質疑応答:Transposon社との独占的ライセンス契約について
質問者:Transposon社のライセンス契約についてです。治療法が確立しておらず、薬剤がきちんとなく、また一部あってもどこまで効くかわからないような神経難病の疾患に対して期待が持てるということで、私も非常に心強く楽しみにしています。
「独占契約」とのお話がありましたが、独占契約と言っても、「日本を含む」「東南アジアを除く」といった注釈がつく場合もあると思います。全世界的な独占契約だと理解してよいでしょうか?
浦田: Transposon社との契約形態は、全世界です。我々が日本だけで取っているわけではありません。
質疑応答:資金繰りについて
質問者:今年1年はいろいろ楽しみなお話をうかがってきましたが、少し気になったのが資金繰りです。今回、楽しみな見通しをうかがいましたが、手元資金17億円あまりでこの1年間やりくりしていけるのでしょうか?
浦田:当社には、販売会社との提携や共同開発の他、国内の製造会社など、多くの提携先があります。資金繰りにおいては、できる限り、このような提携会社から募っていきたいと考えています。
また、「テロメライシン」をきちんと製造して、販売に持っていくという大きな目標に関しては、我々の生存をかけて、あらゆる方法を駆使し資金繰りをしていきます。そして、みなさまにもきちんと還元できるような成果をあげていきたいと考えています。
質疑応答:放射線併用食道がんの臨床試験結果について
質問者:国立がん研究センターの「テロメライシン」の臨床試験結果を見て「あまり効いていないのではないか」と思いましたが、「治験の参加者はがんの病状が重かった」という先ほどのお話を聞き、「そうだったのか」と思った部分もあります。
現在、一番重要な治験である放射線併用食道がんPhase2の治験を行っていますが、承認申請に向けた進捗が当分ストップしてしまうことが一番怖いと感じました。この治験結果が国の審査を通るレベルの水準であることを前提に、会社全体で動いていると思います。しかし、それが思うほどの効果が出なかった場合、どのように対応していくつもりですか?
浦田:内視鏡判定委員会の京都大学・武藤教授と何度かお話ししました。当然、どの症例が効いているのかは教えてもらっておらず、内視鏡で食道がんが消えたかどうかの判定基準は、世界的にも十分に定まっていない状況ですが、今回の治験では厳密な基準を設けて内視鏡の判定をしています。
例えば現在、我々は局所で食道がんが消えたかどうかの判定をしていますが、実際には放射線が当たって、白いケロイド(白苔)ができている場合が見受けられます。内視鏡ではそのケロイドの下にがんが残っているかどうかはわかりません。
食道がんの内視鏡判定には、CR(完全寛解:Complete Response)、PD(進行:Progressive Disease)という言葉がありますが、その中間には「Non-CR・Non-PD」という判定があり、完全には治っていないけど大きく増殖もしていないという判定があります。このカテゴリーが問題で、ここに判定されてしまうと、効果が出ているのか出ていないのかがよくわからなくなってしまいます。このカテゴリーをさらに分類して「完全には消失していないが著明に効果が出ている」という新しい判定、つまりRR(Remarkable Response:著名な効果)という判定基準が、我々の治験が始まった後に日本食道学会で定められました。
例えば、「腫瘍の大きさが90パーセント以上小さくなっている」とか「筋肉層まであったがん(T3)が、粘膜上皮のところまで改善した」というような判定ができるかどうかを検討しています。
このように、「テロメライシン」の効果を適切に評価いただけるように努力しています。結果はまだわかりませんので大丈夫とも言えませんが、このような努力によって、ただ単に結果を待つのではなく、このようなプロセスも加えながら臨床試験の結果を導き出す努力を重ねています。
質疑応答:国内の提携について
質問者:国内の提携についてです。2月には「もう間もなく契約できるかもしれない」といったお話もあったと思います。本日、利益の部分で交渉中だという発言がありましたが、そこがクリアになれば契約締結まで進めるのでしょうか? また、2月の段階ではすでに数社に絞っているということでしたが、現在何社と交渉中しているのか教えてください。
浦田: 交渉している会社は複数ありますが、「一番進んでいる会社が1つはある」ということまではお伝えしたいと思います。「できるだけ早く絞りたい」という我々の気持ちもありますし、いつまでも天秤にかけていても際限がありませんので、優先順位をつけて進めています。
質疑応答:アメリカ大手製薬会社との提携について
質問者:アメリカ大手製薬会社との提携について、上半期に結果を出せるとのご発言があったと思います。上半期が終わる6月まであと3ヶ月くらいですが、結果が出るのは6月ギリギリですか? それとも、もう少し早く決めるのか教えてください。
浦田:先ほどお話ししましたが、第一治療で「ペムブロリズマブ」と化学療法で効かなかった患者に対して、それをレスキューするために「テロメライシン」を上乗せする試験です。2回目の治療として、初めてのセカンドラインセラピーに向かうわけですので、一応Phase2のプロトコルで、現段階では医師主導で取り組むことになっています。
ただし、我々は「なんとか上半期に」という話はしているものの相手は大手製薬ですので、正直なかなか中に入り込めないという事情もあります。目標としては上半期になんとかしたいため、Oncolys USAにはそのように指示しています。
質疑応答:次の治験のプロトコルについて
質問者:治験のプロトコルについてです。次の治験は、Phase2あるいはPhase3なのか、教えてください。また、セミナーか何かで社長がPhase3で契約しているといった発言を聞いたのですが、そのあたりについても教えてください。
浦田:アメリカでの共同開発提携については、Phase2だと理解しています。いきなりPhase3に入るわけではなく、Phase2においてセカンドラインで最初に効かなかった患者に上乗せして効くかどうかをまず確認し、可能となったらPhase3に進むと思います。
質疑応答:Transposon社がM&Aされた場合の影響について
質問者:Transposon社は、現在、3つの治験を進めているわけですが、仮にPhase2a、Phase2bで続々とよい結果が出て、アメリカのメガファーマがM&Aで買収したとします。そして、結ばれた契約などがその時に引き継がれることまでは理解しています。その際、その大きな製薬会社と御社は、どのような関係になるのでしょうか? 例えば、その会社がオンコリスバイオファーマの株を買い取って筆頭株主に名乗りを上げる可能性があるのかについて、いかがでしょうか?
浦田:契約上、詳細はお話しできませんが、仮にTransposon社がM&Aされた場合、当社にはそれなりのお金が入ってきます。また、3億ドル以上のライセンス契約は買収した会社に支払い義務が引き継がれます。オンコリスの株を買うかという件については、Transposon社とも話し合わなければなりませんし、買収先の会社との話にもなりますので、「可能性はない」とは言えません。例えば、仮にTransposon社を買収した会社が「OBP-601」を自由に進めたいとなったら、オンコリスの資本構成に影響してくる可能性があります。
浦田氏からのご挨拶
浦田:いろいろご指導をいただきましてありがとうございました。ご質問内容から、当社に対するみなさまのご期待の大きさを感じました。この場に控えている取締役や執行役員にも、大きく響いたのではないかと思います。
今年は少なくとも「テロメライシン」を承認申請に持って行けるように、社員一同、努力していきたいと思っています。今後とも、ご指導ご鞭撻いただきますよう、よろしくお願いいたします。本日は長時間にわたり、本当にありがとうございました。