2019年2月15日に行われた、株式会社カイオム・バイオサイエンス2018年12月期決算説明会の内容を書き起こしでお伝えします。IR資料
スピーカー:株式会社カイオム・バイオサイエンス 代表取締役社長 小林茂 氏
損益計算書
小林茂氏:カイオム・バイオサイエンスの小林茂でございます。本日は、弊社の決算説明会にお越しいただきまして、ありがとうございます。それではさっそく、2018年12月期の決算説明に入らせていただきます。本日の内容といたしましては、12月期の決算概要、2018年12月期の事業進捗、今後の見通しという流れでご説明したいと思います。
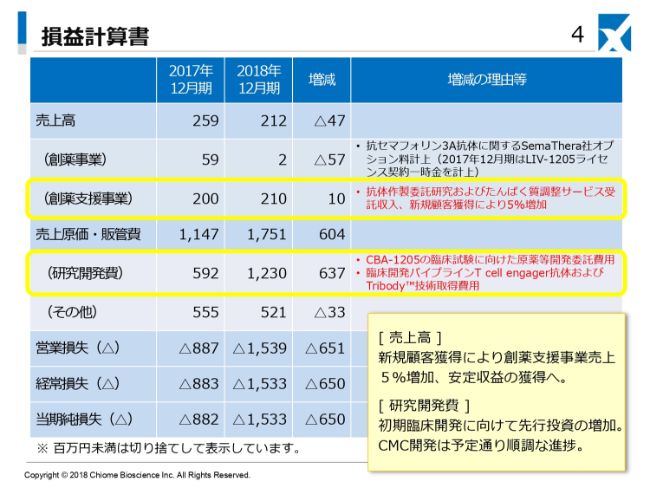
まず、2018年12月期決算概要でございます。(スライドの)損益計算書をご覧ください。売上高は2億1,200万円で、前年同期比でマイナス4,700万円です。創薬事業が200万円で、前年同期比でマイナス5,700万円。創薬支援事業が2億1,000万円で、前年同期比でプラス1,000万円となっております。
この内訳について、創薬事業がマイナス5,700万円となっておりますが、2017年12月期には弊社がスイスのADC Therapeutics社に導出いたしました「LIV-1205」、先方のコードで「ADCT-701」のマイルストーンが含まれております。
当社の売上の主力となっております創薬支援事業につきましては、2017年の2億円から5パーセント増ということで、2億1,000万円となっております。この内訳は後ほどご説明差し上げますが、抗体作製の受託およびたんぱく質調整サービスといった事業からの収入でございます。
研究開発費は、2018年12月期は12億3,000万円となり、前年比で6億3,700万円の増加です。この内訳は、「CBA-1205」の臨床開発の費用で、具体的には原薬製造、GMP製造です。また、製剤製造に着手いる費用。そしてもう1つは、本日のトピックスでもありますが、臨床開発パイプラインの拡充のために、昨年(2018年)12月にイギリスのBiotecnol社から獲得いたしました「Tb-535H」、当社の開発コード「CBA-1535」の獲得費用等が含まれ、研究開発費が増加しております。
(スライドの右下の)四角の欄にコメントをしていますように、売上高としては、受託ビジネスにおける新規顧客の獲得により、創薬支援事業売上が5パーセント増。研究開発費は、初期臨床開発に向けて先行投資が増加しております。
貸借対照表
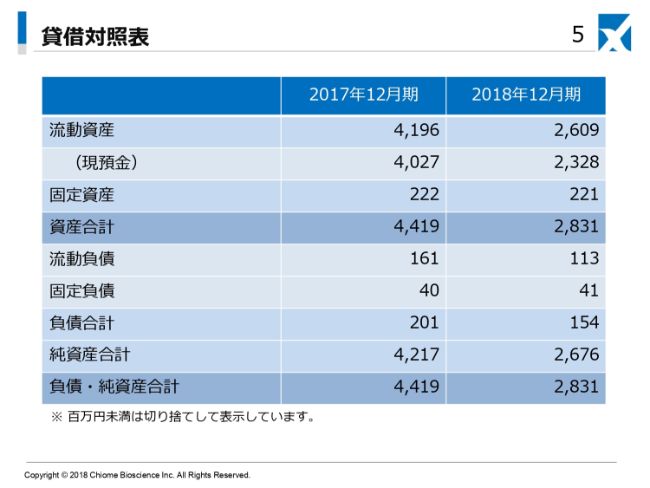
貸借対照表でございます。2018年12月期は、流動資産が26億900万円。現預金が23億2,800万円。固定資産が2億2,100万円。資産合計が28億3,100万円となっております。
キャッシュフロー計算書
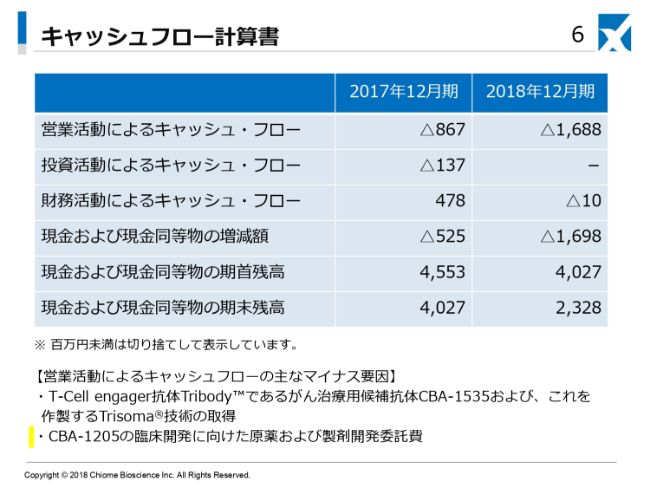
キャッシュフローでございます。2018年12月期は、営業活動によるキャッシュ・フローがマイナス16億8,800万円。財務活動によるキャッシュ・フローがマイナス1,000万円。したがいまして、現金および現金同等物の増減額が16億9,800万円の減となっております。
この結果、2018年12月期の現金および現金同等物の期末残高は23億2,800万円となりました。2017年12月期が40億2,700万円で、2018年12月期が23億2,800万円となっております。この分が、先ほど申し上げた臨床開発パイプラインの進捗およびパイプラインの獲得に充てられました。
事業進捗ハイライト
2018年12月期の事業進捗につきまして、ご説明申し上げます。全体を通して一言で申し上げるならば、私どもは2017年に創薬に向けて方向を変え、昨年1年間やってまいりまして、ようやく足元が固まってきたかなと思います。これからの成長に向けての手掛かりが見えてきた年になったと考えております。
まず、事業進捗ハイライトです。2つのメインビジネスのうちの1つ目である創薬事業では、臨床パイプラインの拡充で成果を上げられた年だと考えております。
「ADLib®システム」で創製した抗セマフォリン3A抗体は、「BMAA」というコードです。この抗体は、長年にわたりカイオムで導出作業を続けてまいりましたが、2018年3月にカナダのSemaThera社とオプション契約の締結に至りました。
また、臨床試験に向けたパイプラインといたしまして、「ADCT-701」をスイスのADC Therapeutics社に導出しました。また、「CBA-1205」のDLK-1抗体は自社開発品で、これから我々が自社で開発を行っていくものです。いずれも臨床試験に向けて順調に準備が進んでおります。
具体的には、原薬の製造あるいは治験薬の製造といった段階に入ってきてまいりました。一般的には、臨床ステージになると、ものづくりのところで遅れが出たりしますが、幸い両プロジェクトとも進捗が見られています。
前臨床パイプラインの拡充については、先ほどご紹介させていただきました「CBA-1535」をイギリスのBiotecnol社から獲得いたしました。こちらも、これから臨床試験に向けて準備を進めてまいります。今期、製薬事業では、このような(スライドに挙げた)3つの成果が上げられたかなと考えております。
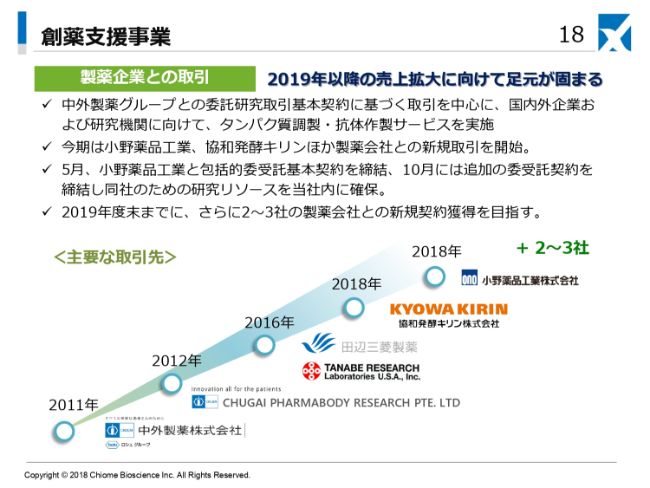
また、もう1つの事業である創薬支援事業では、ここ(スライド)に書いてあるように、国内の主要な抗体医薬企業との取引が増加したということで、具体的な成果が上げられたと考えております。
中身としては、これまでこの事業セグメントでは、中外製薬さんにほぼ1社依存的なビジネスを展開していましたが、2018年12月期には小野薬品工業さんと包括的委受託基本契約および追加の委受託契約締結を結ぶことに至り、実際に売上が立ってきております。
また、バイオファーマシューティカルあるいはバイオテクノロジーの東西の雄の1つと数えられております協和発酵キリンさんとも取引を開始いたしまして、2018年12月期の売上として立っております。
従来は中外製薬さん1社にかなりの売上を依存していましたが、複数の顧客をつかんだということで、安定的な事業基盤ができつつあるといえるかと思います。
創薬事業(パイプライン)
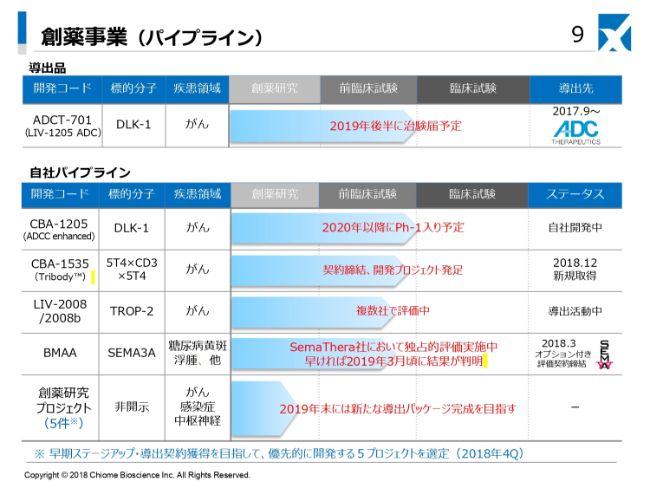
あらためて事業別にご説明いたします。まず、創薬事業のパイプライン一覧表でございます。最初に、導出品です。ここ(スライドの一番上)に書いてあります「ADCT-701」は、2017年9月にADC抗体としての権利をスイスのADC Therapeutics社に導出しております。本抗体につきましては、先方独自で開発を進めておりまして、本年の後半には治験申請、さらに年内には臨床試験が開始されるものと期待されております。
自社パイプラインは、一番進んでいますのがDLK-1抗体の「CBA-1205」です。これはファーストインクラスの抗体でして、先行品・競合品はございません。自社開発ということで、CMC、臨床試験用の原薬、製剤の製造検討、そしてGLP試験が始まるという状況になっています。
その次の「CBA-1535」は、イギリスのBiotecnol社から獲得した多重特異性抗体です。これもがん領域で契約を締結いたしまして、非臨床試験ではデータ獲得がほぼ終了しています。今後はものづくりに注力し、こちらも私どもで臨床試験に入れていく予定です。
「LIV-2008」は、抗TROP-2抗体です。この抗体につきましては、すでにADC抗体として先行品があることから、私どもでは、導出パッケージを揃えたところで導出という方向で注力しています。現在、海外の複数社にて評価を受けているところです。
「BMAA」は、抗セマフォリン3A抗体で、対象疾患は糖尿病黄斑浮腫という病気です。2018年3月に、カナダのSemaThera社とオプション契約を締結いたしまして、現在、先方にて独占評価中です。2019年の第1四半期の終わり頃には、なんらかの結果が出てくると期待しているところです。
これらが、臨床あるいは臨床に近いところのパイプラインでございます。私どもは、この他に創薬研究プロジェクトを持っており、現在5つのプロジェクトに絞って、がん領域・感染症領域・中枢神経領域で研究開発を進めています。これらの中から、2019年末には新たな導出パッケージのデータを取るところまで進めることを目指しています。
創薬事業(パイプライン) トピックス①
続きまして、個々のパイプラインについて少し詳しくご説明申し上げます。まずトピックスとして、「CBA-1535」です。こちらはイギリスのBiotecnol社から獲得したがん治療用抗体で、T cell Engager抗体と呼んでいます。こちらの抗体と抗体改変技術をあわせて取得しています。
こちらつきましては、「CBA-1535」として私どもで開発を進めてまいります。これからご説明申し上げますが、「Tribody™」という総称のフォーマットの抗体では、世界で初めての臨床試験となってまいります。
「Tribody™」と申しますのは……IgG抗体は、この(スライドの右側にある図の)ようなY字型で表されることが多いのですが、このYの2つの手を広げた部分が、標的が抗原に結合する部位です。この「Tribody™」というフォーマットは、抗原・標的に結合する部分が3つあり、それにより、それぞれ異なる標的と結合することができるという特徴を持った抗体です。
ここ(スライド)に書いてありますが、「Tribody™」は、こういった3つの結合部分を持つ抗体のフォーマットの総称でして、これを作製する技術を「Trisoma®」と申します。Biotecnol社が開発したものでございます。先ほど申し上げましたように、1つの分子の中に3つの異なる抗原結合部位があって、異なる機能を組み合わせることができるというメリットがあります。
「CBA-1535」は、がんの腫瘍細胞に広く発現している5T4という標的に、2つの手で結合するようになっています。残りの1つの手で、がんの腫瘍細胞を叩く免疫細胞(T細胞)に結合し、T細胞を活性化することによってがん細胞を叩きます。したがって、腫瘍細胞とT細胞があると、その間をブリッジしてしまうわけです。がん細胞の極めて近くにT細胞を持ってきて、それをさらに活性化することによってがん細胞を叩くという、一種のImmuno-Oncorogy(がん免疫治療)の手法でございます。
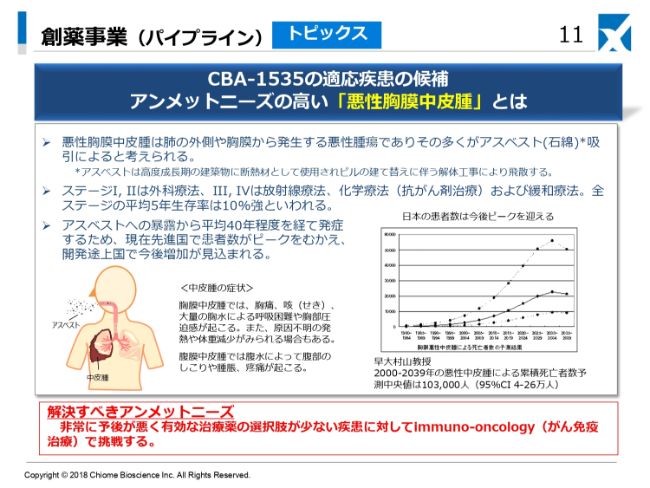
想定される適応疾患としては、悪性中皮腫、小細胞肺がん、あるいは非小細胞肺がんなど、幅広い固形腫瘍が考えられます。現在、私どもといたしましては、最初の開発のターゲットとして悪性胸膜中皮腫を考えています。
創薬事業(パイプライン) トピックス②
この悪性胸膜中皮腫と申しますのは、私どもが子どものころは、よく家とか家屋、あるいはビルの断熱材にアスベストを使っていました。高度成長期に建てられたビルディングあるいは家屋が、建て替えの時期にきて壊されることによって、その断熱材として使われていたアスベストが飛散します。それを吸引することによって、長い間経ったときに、体内でそれが悪性の中皮腫としてがん化してくることが非常に問題になっています。
問題になってくるのは、発症までに時間がかかることと、よい治療法がないことです。普通は、ステージⅠ・Ⅱの場合は外科療法ですが、肺および胸膜といったものをかなり広い範囲で切除することになります。それで治療ができない場合には化学療法・放射線療法となるわけですが、いずれも平均5年生存率が10パーセント程度といわれている、非常にアンメットニーズの高いがん腫でございます。このがん腫に、先ほど申し上げました5T4という抗原が広く発現しているということで、ターゲットとして選んでいます。
適応症選定のもう1つの理由としては、悪性胸膜中皮腫は患者さんの数はそんなに多くはないため、オーファンドラッグの範疇に入る可能性が高いです。そうなれば、臨床試験も比較的小規模に実施できるということで、我々のようなコンパクトなベンチャーに合った臨床試験のデザインで開発を進めることができるということもございます。
ご参考までに、悪性中皮腫というのは、(スライドの)グラフが小さくて大変恐縮ですが、日本での患者さんの数はまだまだ増えていきます。日本でこれですから、海外の開発途上国ではさらにこの後にピークがくるという状況になります。
私どもは、この「CBA-1535」という抗体をBiotecnol社から獲得したわけでございますが、Biotecnol社ではすでに臨床試験に入るためにほぼ十分な非臨床試験を終了しています。したがいまして、ものを作って、GMP製造ができるようにするところが、これからの私どものメインの仕事になってまいります。
創薬事業(パイプライン)―導出品―
次に、パイプラインの開発進捗状況です。「ADCT-701」は、ADC Therapeutics社に導出したものです。原薬製造で一部遅れが認められたということではありますが、本年後半にIND(治験申請)を申請して、年内にフェーズⅠが開始できるものと聞いています。
創薬事業(パイプライン)―自社開発品―
「CBA-1205」は自社開発品で、ファーストインクラスの抗体です。繰り返し申し上げていますように、ターゲットはDLK-1です。臨床開発に向けて、抗腫瘍活性の1つであるADCC活性を高めたMaster Cell Bank(MCB)の構築が完了しました。Master Cell Bankの構築が完了したということは、製造面では商業生産のための準備がほぼ整ったということです。
また、動物モデルでは、単剤と同様に、肝臓がんに対する既存薬との併用効果もすでに観察しています。さらに、本抗体の自社開発を進めていくために、(2018年)9月には臨床開発部を発足し、現在、臨床開発のCROの選定等を進め、臨床開発計画を策定してスピードアップを図っているところです。
創薬事業(パイプライン)―導出候補品―①
「LIV-2008」は、抗TROP-2モノクローナル抗体です。こちらは、薬効評価試験および非臨床試験の部分が、当社でほぼ終了しています。また、Research Cell Bankという、研究段階でも大量スケールでものづくりができるような状態・プロセスも、ほぼ構築できているということで、導出用パッケージができています。これをもちまして、現在、私どもは導出作業を進めています。
現在、複数の海外の会社で評価をいただいていまして、その中にはベンチャー、欧米の中堅製薬企業、あるいは欧米のグローバルな大手製薬企業も含まれています。早いところでは、今年の前半頃に一部評価結果が出てくるかなと期待しています。
創薬事業(パイプライン)―導出候補品―②
次に、こちらも導出候補品ですが、BMAA(ヒト化抗セマフォリン3Aモノクローナル抗体)。ファーストインクラスの抗体でございます。私どもは、長い間、こういった席で毎回この抗体を紹介してまいりましたが、2018年3月にカナダのSemaThera社と契約が締結されまして、現在SemaThera社において糖尿病黄斑浮腫を対象とした評価を進めています。
契約締結が2018年3月ですから、そろそろ1年経つということで、なんらかの評価結果が出てくるのではないかと期待しています。
創薬事業(パイプライン)―導出候補品―③
対象となる疾患は、糖尿病黄斑浮腫(DME)です。この病気は、腎症・神経障害とあわせて、網膜症あるいは黄斑浮腫が糖尿病の3大合併症の1つになっていまして、日本では成人の失明原因の第1位となっています。
糖尿病が長い間続くことによって、血管がもろくなり、血管壁から血液成分が漏出していきます。それが網膜の中にたまることで網膜浮腫が起こり、いずれ失明に至るという、非常に危険な疾患です。実際に黄斑浮腫になりますと、この(スライドの写真の)ように、見える部分がゆがんだり、視野の中央に暗い部分ができます。
現在、糖尿病黄斑浮腫に対して唯一使われているのが、血管新生阻害剤(抗血管新生薬)の抗VEGF薬です。商品名でいいますと、「アイリーア®」「ルセンティス®」といった製品です。
この疾患の特徴として、論文上では、病態が進むにつれてVEGFの役割が大きくなってくると(されています)。VEGF阻害剤で叩いてやることで、疾患の状態をよくする、あるいは治すということが行われていますが、最近の研究では、VEGFが主要な役割を果たす前に、SEMA3Aがこの疾患の進展に役割を果たしている部分があると(いわれています)。
したがって、ここをセマフォリン3Aの阻害剤で抑えてやることによって、早い段階で黄斑浮腫を抑える、あるいは治療することができるのではないかというコンセプトです。
創薬事業(創薬プロジェクト、他)
次に、創薬事業(創薬プロジェクト)でございます。創薬研究プロジェクトについては、探索段階から、抗体作製、in vitroでの機能性評価、それに続いてin vivoでの活性評価を行っているプロジェクトがございます。パイプライン拡充のために、国内の大学や研究機関と連携しながら、アンメットニーズが存在する疾患領域の共同研究を実施して、プロジェクト化してまいりました。
その結果、第4四半期には、既存プロジェクトのうち優先的に資源を割り振るものとして、5プロジェクトを選定いたしました。がんが3つ、中枢が1つ、感染症が1つという内訳でございます。あくまでも私どもは、「アンメットニーズを抗体で攻略できること」をキーワードとして、初期のプロジェクトを立ち上げています。
「コアコンピタンスの強化」と(スライドに)書いてありますのは、私どもの抗体作製プラットフォームである「ADLib®システム」の技術開発はもちろん、ライブラリや「ハイブリドーマ」「B cell cloning」といった複数の抗体作製プラットフォームを駆使することによって、よい抗体を速くたくさん取るということに取り組んでいます。
さらに、できてきた抗体の性能をさらに上げる……例えば、親和性を向上させたり、あるいは、「Tribody™」といったフォーマットに乗せていくなど、抗体エンジニアリングと組み合わせて、さらに私どもの強みを活かして、治療用抗体を開発していこうという戦略でございます。
創薬支援事業
一方、創薬支援事業は、今年以降の売上拡大に向けて足元が固まってきたという感じがしています。いうまでもなく、中外製薬グループさんが依然として最重要顧客でありますが、中外製薬さんとのお取引を通じて培ってきた私どもの高品質のサービスが評価され、今期は小野薬品工業さん、協和発酵キリンさんといった製薬企業とのお取引が始まっています。すでにリピーターとして、私どもをお使いいただいている状況でございます。
単発の案件も含めますと、その他の製薬メーカーさんからも引き合いをいただいています。小野薬品工業さんについて申し上げると、(2018年)5月に包括的な委受託基本契約を締結いたしまして、さらに10月に追加の委受託契約を締結いたしました。私どもとしては、小野薬品工業さんに優先的にリソースを振り向けるという施策も打っています。
2019年は、ここにさらに2~3社増やしていこうかと(考えています)。ただし、闇雲に顧客の数を増やすということではなく、品質の高い私どものサービスをご理解いただいて、長い目でお付き合いいただけるようなお客さまと信頼関係を結んでいきたいと考えています。
今後の見通し(2019年12月期)
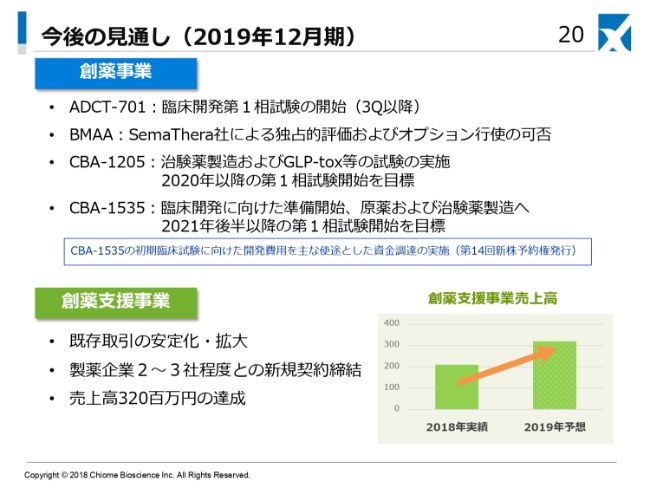
今後の見通しでございます。2019年12月期には、創薬事業で先ほどご説明差し上げましたように、「ADCT-701」はまだこちらから見守っているという感じですが、本年中の臨床試験入りが期待されています。
BMAA(ヒト化抗セマフォリン3Aモノクローナル抗体)につきましては、本年中にSemaThera社の評価結果が出てきて、オプション権の行使の可否がおそらくわかってくるだろうと(見込んでいます)。
「CBA-1205」につきましては、治験薬製造およびGLP-tox等の臨床試験の開始に必要なことを、予定どおりに粛々と進め、2020年以降の第1相の臨床試験に入っていくことを目標としています。
また、Biotecnol社から獲得した臨床パイプラインの「CBA-1535」につきましては、原薬および治験薬製造といったものづくりのところに重点的に力を入れていくことになりますが、2021年後半以降の第1相臨床試験を目指しています。なお、「CBA-1535」の初期臨床開発・CMC開発を目的に、資金調達の実施(第14回新株予約権発行)をいたしました。
創薬支援事業につきましては、先ほどからお話ししているとおり、既存取引先のビジネスの安定化、そしてさらなる拡大といったところ(を目指します)。そして、新たに2~3社程度との契約を締結したいと考えており、2019年12月期の売上目標は3億2,000万円と、(2018年12月期から)約50パーセント増を見込んでいます。
以上、少し長くなりましたが、2018年12月期の決算のご説明を申し上げました。ありがとうございました。